- Головна
- Готові шкільні презентації
- Презентація на тему «Історія відкриття атома»
Презентація на тему «Історія відкриття атома»
259
Слайд #1
Робота Учениці 10 А класу
Воловецької ЗОШ
Фельбаби Юлії
Історія відкриття атома
Воловецької ЗОШ
Фельбаби Юлії
Історія відкриття атома

Слайд #2
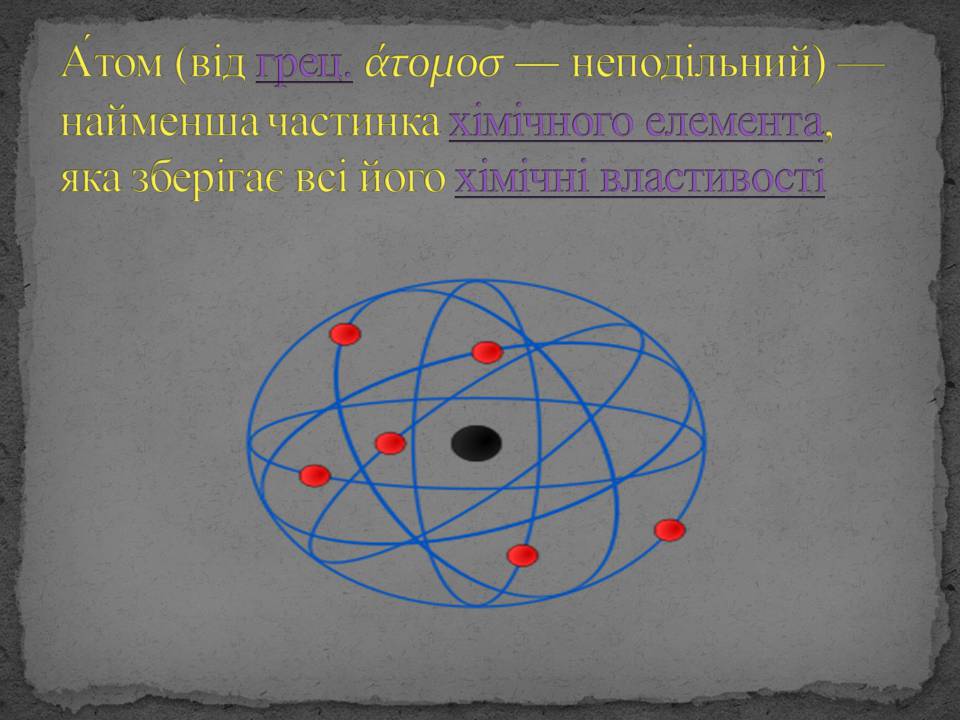
А́том (від грец. άτομοσ — неподільний) — найменша частинка хімічного елемента, яка зберігає всі його хімічні властивості
Слайд #3
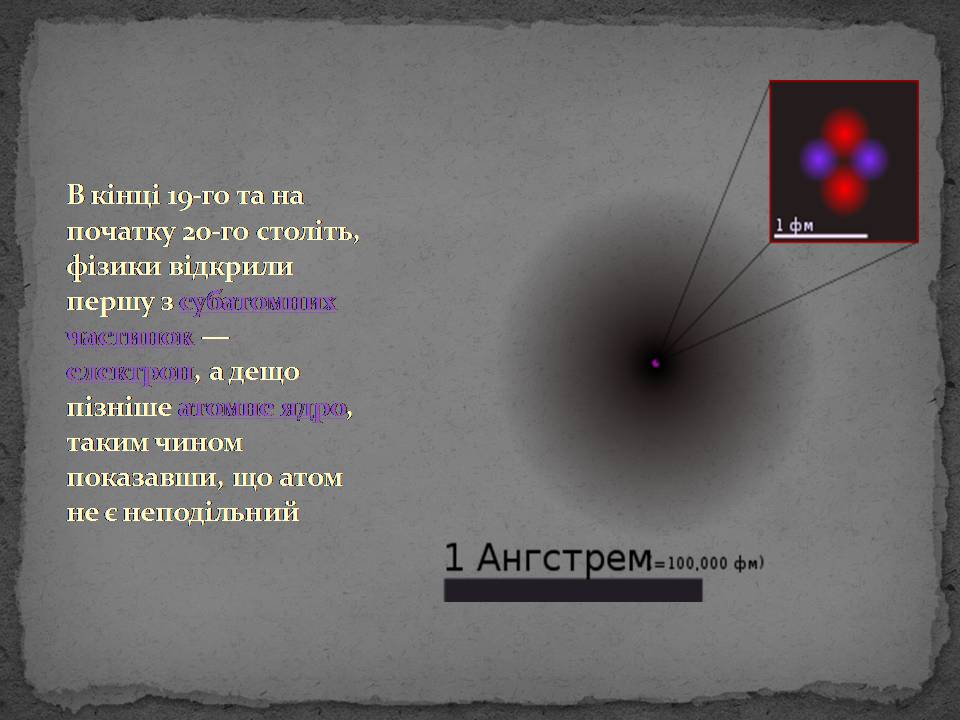
В кінці 19-го та на початку 20-го століть, фізики відкрили першу з субатомних частинок — електрон, а дещо пізніше атомне ядро, таким чином показавши, що атом не є неподільний
Слайд #4
Ядро оточене електронною хмарою, яка займає більшу частину його об'єму. В електронній хмарі можна виділити оболонки, для кожних з яких існує кілька можливих орбіталей. Заповнені орбіталі складають електронну конфігурацію, властиву для кожного хімічного елемента. Кожна орбіталь може містити до двох електронів, що характеризуються трьома квантовими числами: основним, орбітальним і магнітним.

Слайд #5
Приклад електронних орбіталей

Слайд #6
Основна маса атома зосереджена у ядрі, яке складається з нуклонів: протонів і нейтронів, зв'язаних між собою силами ядерної взаємодії. Існує 118 атомів , з яких відкрито лише 115

Слайд #7
Хімічні властивості атома визначаються в основному валентними електронами — електронами на зовнішній оболонці. Кількість електронів на зовнішній оболонці визначає валентність атома.

Слайд #8
Першим почав проповідувати атомістичне вчення в 5 столітті до нашої ери філософ Левкіпп. Потім естафету підхопив його учень Демокріт. Збереглися лише окремі фрагменти їх робіт, з яких стає зрозумілим, що вони виходили з невеликої кількості досить абстрактних фізичних гіпотез:

Слайд #9
Одна з перших теорій про будову атома, яка має вже сучасні обриси, була описана Галілеєм (1564—1642). За його теорією речовина складається з часток, які не перебувають в стані спокою, а під впливом тепла рухаються у всі сторони; тепло — є нічим іншим як рухом часток. Структура часток є складною, і якщо позбавити будь-яку частку її матеріальної оболонки, то зсередини бризне світло. Галілей був першим, хто, хоча і в фантастичній формі, представив будову атома.

Слайд #10
У 19 столітті Джон Дальтон відкрив закон кратних відношень і, виходячи з нього розвинув теорію, названу ними «новою системою хімічної філософії», за якою хімічні речовини складаються з атомів, але він припускав, що вони неподільні[10]. Новий поштовх у становленні сучасного розуміння атома дала молекулярно-кінетична теорія.

Слайд #11
1897 року Джозеф Джон Томсон, вивчаючи катодні промені, відкрив електрон і прийшов до висновку, що вони є у кожному атомі. Таким чином, було спростоване припущення, що атоми є неподільними компонентами речовини

Слайд #12
Надзвичайно великий внесок у дослідження атома вніс Менделєєв Дмитро Іванович , що запропонував і встановив періодичне розміщенняя хімічних елементів опираючись на будову атома , і масу ядра

Слайд #13
Нажаль атом має і багато згубних дій

Слайд #14
У 1898 році Марія Складовська відкрила термін випромінювання . А у 1902 вона відкрила – Радій , в період розпаду якого , доза можливого випромінення перевищує норму в декілька десятків разів , за що в період розпаду даний хімічний елемент в тому числі і його атомна одиниця і ізотопи є вкрай небезпечними для життя . Зробивши вагомий внесок у дослідження атома , вона дала поштовх до його використання в майбутньому

Слайд #15
За допомогою досліджень Марії Складовської , було також винайдено так званий “ мирний атом “ що служить людству до сьогоднішніх днів

Слайд #16
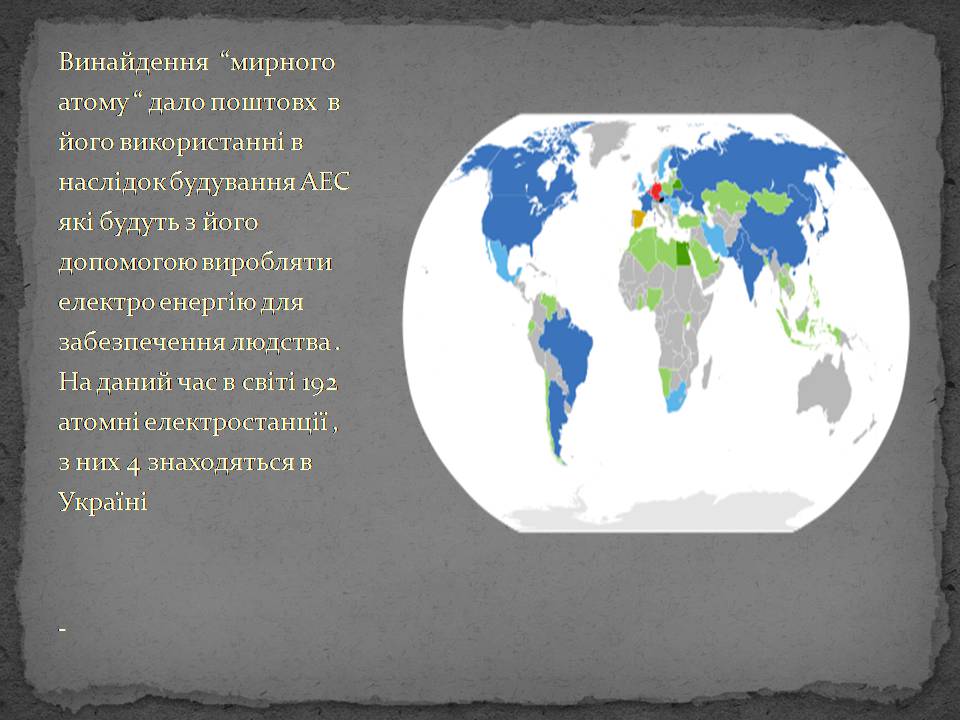
Винайдення “мирного атому “ дало поштовх в його використанні в наслідок будування АЕС які будуть з його допомогою виробляти електро енергію для забезпечення людства . На даний час в світі 192 атомні електростанції , з них 4 знаходяться в Україні
-
-
Слайд #17
Та прикрий досвіт ЧАЕС закликає людство до альтернативних способів електроенергії і змушує більш серйозно ставитись до можливих наслідків використання атома ! Бо не важливо скільки років тому було винайдено атом і яку користь він приносить , важливо які згубні наслідки при найменшій похибці він заподіє всьому живому
