- Головна
- Готові шкільні презентації
- Презентація на тему «Електроліз» (варіант 4)
Презентація на тему «Електроліз» (варіант 4)
1219
Слайд #1
ЕЛЕКТРОЛІЗ (перевірка закону, застосування)Мета: Дослідним шляхом ознайомитись з явищем електролізу, перевірити закон Фарадея та визначити електрохімічний еквівалент міді
Робота
учня 11 класу
ЗШ І-ІІІ ступенів №2
м. Гайворон
Недзи Анатолія
2012/2013р
Робота
учня 11 класу
ЗШ І-ІІІ ступенів №2
м. Гайворон
Недзи Анатолія
2012/2013р

Слайд #2
ЗМІСТ РОБОТИ:
Історична довідка
Майкл Фарадей та його закон
Визначення поняття “Електороліз”
Лабораторна робота в домашніх умовах
Лабораторна робота в лабораторних умовах
Застосування електролізу
Висновок
Історична довідка
Майкл Фарадей та його закон
Визначення поняття “Електороліз”
Лабораторна робота в домашніх умовах
Лабораторна робота в лабораторних умовах
Застосування електролізу
Висновок

Слайд #3
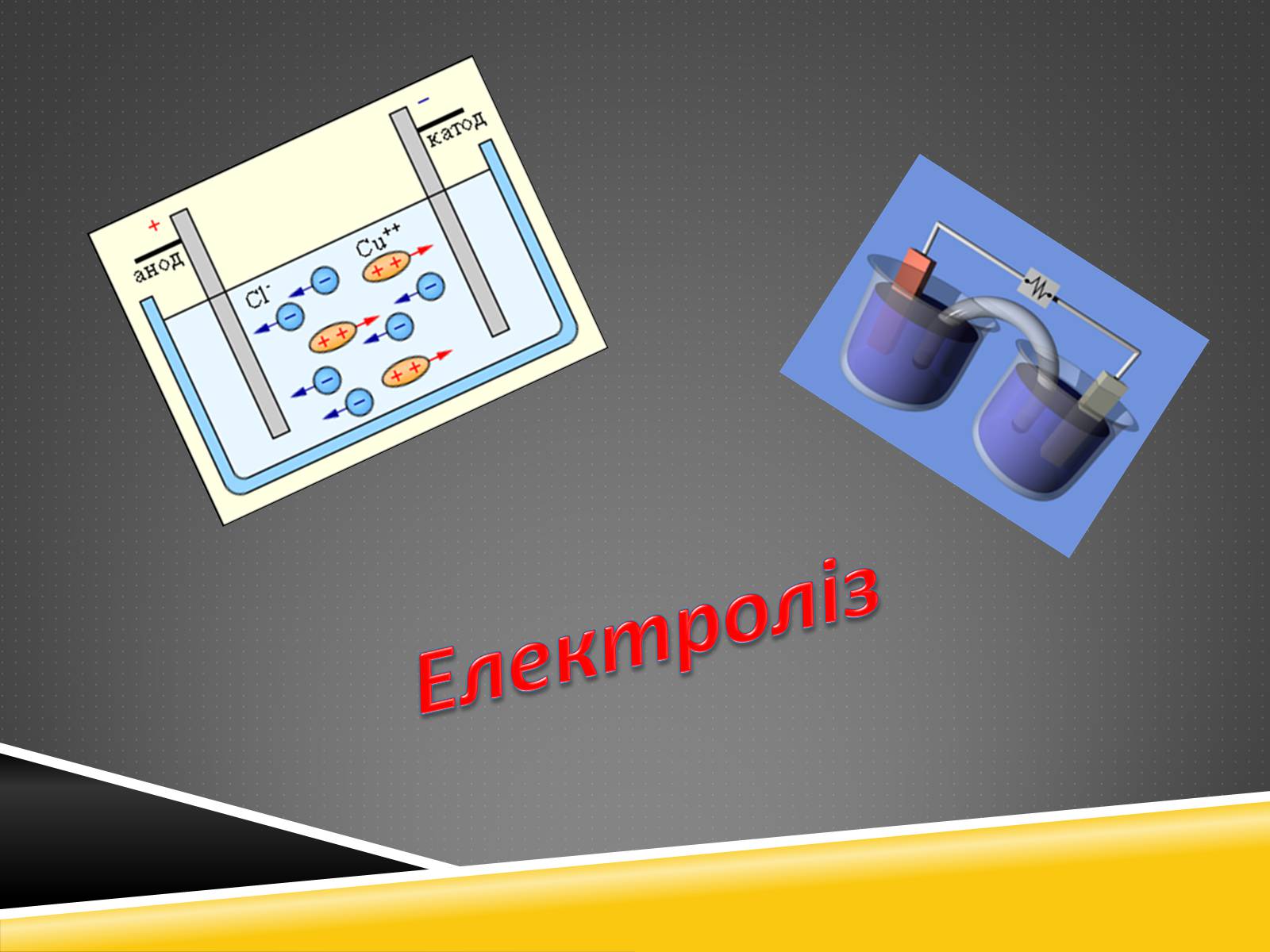
Електроліз
Слайд #4
«Наука виграє, коли її “крила” розковані фантазією.»
«Не буває нічого занадто фантастичного для того, щоб бути правдою, якщо це співпадає із законами природи.»
Майкл Фарадей
«Не буває нічого занадто фантастичного для того, щоб бути правдою, якщо це співпадає із законами природи.»
Майкл Фарадей

Слайд #5
Електроліз (від електро... і греч.(грецький) lysis — розкладання, розчинення,
(розпад), сукупність процесів електрохімічного окислення-відновлення занурених в електроліт електродах при проходженні через нього електричного струму. Електроліз лежить в основі електрохімічно методу лабораторного і промислового здобуття різних речовин — як
простих (електроліз у вузькому сенсі слова), так і складних (електросинтез ) .
Вивчення і вживання електролізу почалося в кінці 18 — початку 19 ст. в період становлення електрохімії, для розробки теоретичних основ. Велике значення мало встановлення М. Фарадєєм в 1833—34 точних співвідношень між кількістю електрики, пройденого при електролізі, і кількістю речовини, що виділилася на електродах..
Майкл Фарадей
(1791-1867) рр.
(розпад), сукупність процесів електрохімічного окислення-відновлення занурених в електроліт електродах при проходженні через нього електричного струму. Електроліз лежить в основі електрохімічно методу лабораторного і промислового здобуття різних речовин — як
простих (електроліз у вузькому сенсі слова), так і складних (електросинтез ) .
Вивчення і вживання електролізу почалося в кінці 18 — початку 19 ст. в період становлення електрохімії, для розробки теоретичних основ. Велике значення мало встановлення М. Фарадєєм в 1833—34 точних співвідношень між кількістю електрики, пройденого при електролізі, і кількістю речовини, що виділилася на електродах..
Майкл Фарадей
(1791-1867) рр.

Слайд #6
Застосування електрики в першій частині 19-го століття дало поштовх виготовленню магнію та алюмінію з застосуванням електролізу. Ці метали були використані в піротехніку для створення яскравих іскри і білого полум'я. Після цього були отримані барій, стронцій, сполуки міді які здатні створювати червоний, зелений і синім відтінок вогню. Ці склади отримали застосування в 20 столітті і піротехнічні технології дійсно злетіли.
Феєрверки, які сьогодні застосовується для торжеств і веселощів були відкриті в 16-го столітті в Росії, (Петро Перший був одним із затятих цінителів мирного застосування салютних виробів).
Не всі знають, що електроепіляція (не плутати з електродепіляціей), що також називається електролізом, дозволяє позбутися від зайвих волосків на тілі назавжди. У цій процедурі в фолікул волосся вводиться дуже тонкий електрод у вигляді голки. На цей електрод подається мікрострум, який руйнує саму волосяну цибулину.
Цікавий факт
Феєрверки, які сьогодні застосовується для торжеств і веселощів були відкриті в 16-го столітті в Росії, (Петро Перший був одним із затятих цінителів мирного застосування салютних виробів).
Не всі знають, що електроепіляція (не плутати з електродепіляціей), що також називається електролізом, дозволяє позбутися від зайвих волосків на тілі назавжди. У цій процедурі в фолікул волосся вводиться дуже тонкий електрод у вигляді голки. На цей електрод подається мікрострум, який руйнує саму волосяну цибулину.
Цікавий факт

Слайд #7
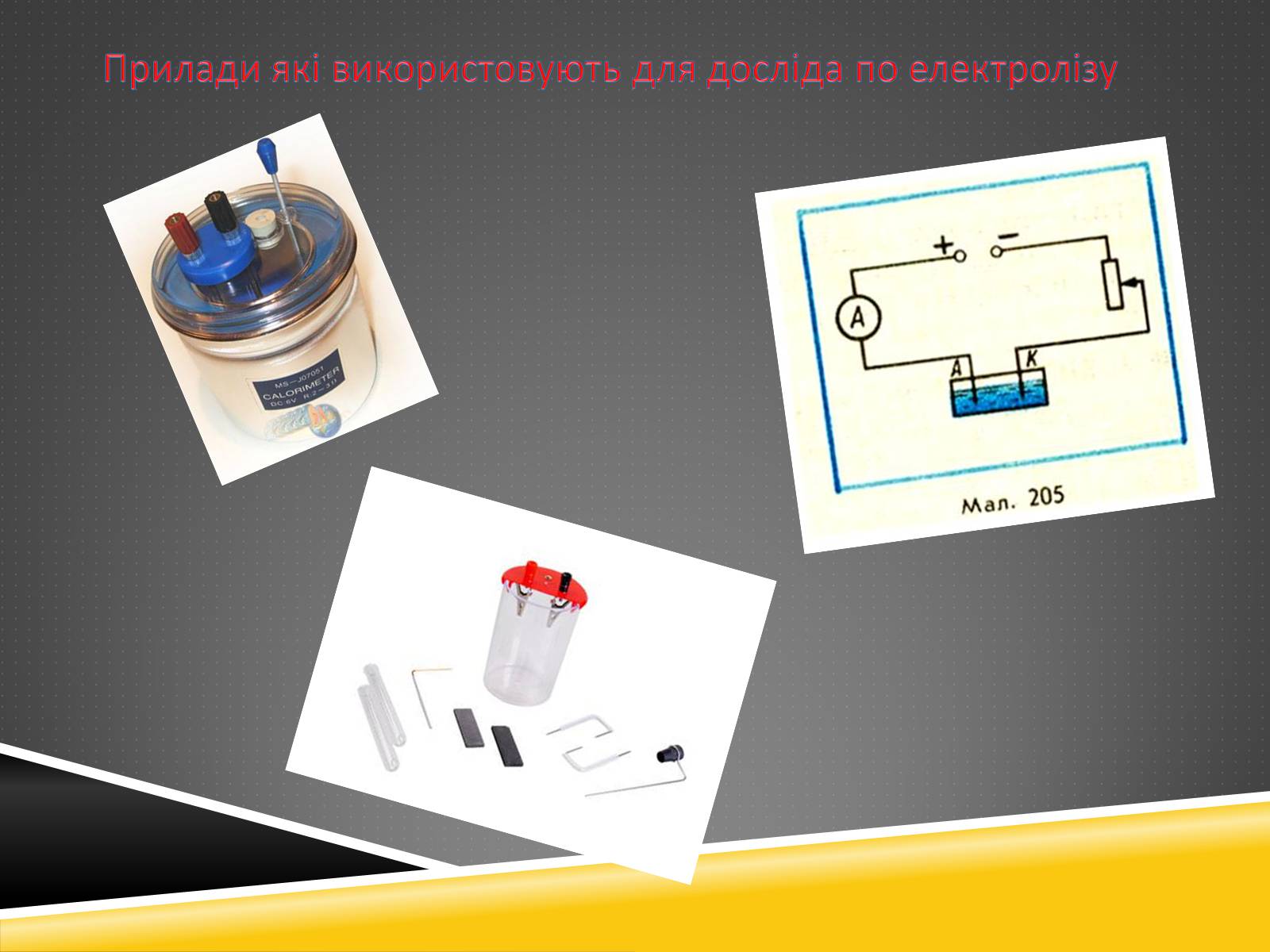
Прилади які використовують для досліда по електролізу
Слайд #8
Для того щоб провести електроліз води в домашніх умовах, я використовував таке обладнання. Ємність, куди наливав воду, сіль , джерело живлення, два електроди (з будь-якого металу).
В ємність налив воду, до води на чверть обсягу ємності присипав сіль і перемішав, у розчин опустив електроди, з'єднані з джерелом живлення (струм не менше 0.5А).
Відбулося скипання розчину, про що свідчать бульбашки на одному з електродів. Це і буде електроліз . Продуктом електролізу став водень і кисень.
Дослід, який можна провести вдома
В ємність налив воду, до води на чверть обсягу ємності присипав сіль і перемішав, у розчин опустив електроди, з'єднані з джерелом живлення (струм не менше 0.5А).
Відбулося скипання розчину, про що свідчать бульбашки на одному з електродів. Це і буде електроліз . Продуктом електролізу став водень і кисень.
Дослід, який можна провести вдома

Слайд #9
1. Вибираю один із двох електродів і позначаю його, наприклад, шматочком пластиліну. Це буде мій катод.
2. За допомогою терезів визначаю його масу якомога точніше.
3. Збираю коло за схемою, послідовно з'єднавши всі прилади між собою. Знаю, що катод треба з'єднувати з негативним полюсом джерела струму!
4. Замикаю коло та одночасно вмикаю секундомір.
5. Спостерігаю процес електролізу протягом 20 хвилин; при цьому слідкую за показами амперметра та регулюю силу струму за допомогою реостата так, щоб її значення було постійним впродовж усього досліду.
6. По закінченні процесу вимикаю струм і виймаю катод із розчину, одночасно вимикаю секундомір і записую його показання до таблиці.
7. Обережно кладу катод на серветку і даю трохи підсохнути.
8. Спостерігаю появу на катоді шару міді, який має червоний відтінок.
9. За допомогою терезів визначаю масу катода після електролізу.
10. Знаходю у довіднику табличне значення електрохімічного еквіваленту міді.
11. Записую отримані дані у таблицю.
12. Визначаю масу міді за законом Фарадея для електролізу m = kІt
13. Порівнюю значення маси, отримані за результатами обчислень та результатами досліду.
ХІД РОБОТИ
2. За допомогою терезів визначаю його масу якомога точніше.
3. Збираю коло за схемою, послідовно з'єднавши всі прилади між собою. Знаю, що катод треба з'єднувати з негативним полюсом джерела струму!
4. Замикаю коло та одночасно вмикаю секундомір.
5. Спостерігаю процес електролізу протягом 20 хвилин; при цьому слідкую за показами амперметра та регулюю силу струму за допомогою реостата так, щоб її значення було постійним впродовж усього досліду.
6. По закінченні процесу вимикаю струм і виймаю катод із розчину, одночасно вимикаю секундомір і записую його показання до таблиці.
7. Обережно кладу катод на серветку і даю трохи підсохнути.
8. Спостерігаю появу на катоді шару міді, який має червоний відтінок.
9. За допомогою терезів визначаю масу катода після електролізу.
10. Знаходю у довіднику табличне значення електрохімічного еквіваленту міді.
11. Записую отримані дані у таблицю.
12. Визначаю масу міді за законом Фарадея для електролізу m = kІt
13. Порівнюю значення маси, отримані за результатами обчислень та результатами досліду.
ХІД РОБОТИ

Слайд #10
Електроліт — це розчин або розплав, що проводить електричний струм. Причиною дисоціації є не електричне поле, а дія розчинника або нагрівника.
Електроліз — це процес виділення на електродах речовин внаслідок відновлювально-окислювальних реакцій, що відбуваються на електродах.
Рекомбінація – процес об'єднання іонів у нейтральні молекули.
m — маса речовими.
μ — молярна маса
NA — стала Авогадро,
N —tкількість іонів,
Z — валентність
e — заряд електрона,
I—сила струму,
F — стала Фарадея.
Закон електролізу
m = k·I·t
F = NAe
Теоретичні дані
Електроліз — це процес виділення на електродах речовин внаслідок відновлювально-окислювальних реакцій, що відбуваються на електродах.
Рекомбінація – процес об'єднання іонів у нейтральні молекули.
m — маса речовими.
μ — молярна маса
NA — стала Авогадро,
N —tкількість іонів,
Z — валентність
e — заряд електрона,
I—сила струму,
F — стала Фарадея.
Закон електролізу
m = k·I·t
F = NAe
Теоретичні дані

Слайд #11
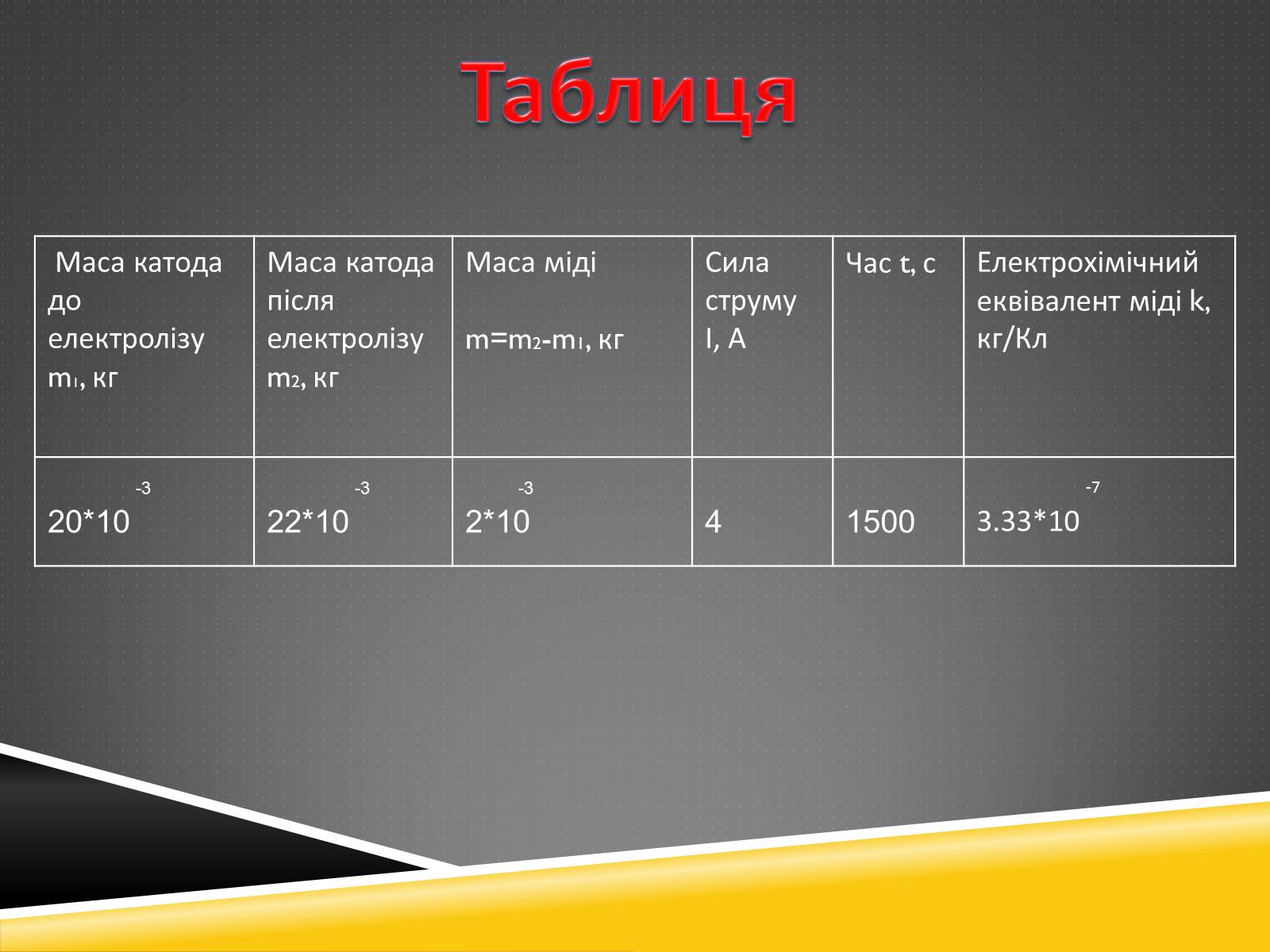
Маса катода до електролізу m1, кг
Маса катода після електролізу m2, кг
Маса міді
m=m2-m1, кг
Сила струму І, А
Час t, с
Електрохімічний еквівалент міді k, кг/Кл
-3
20*10
-3
22*10
-3
2*10
4
1500
-7
3.33*10
Таблиця
Маса катода після електролізу m2, кг
Маса міді
m=m2-m1, кг
Сила струму І, А
Час t, с
Електрохімічний еквівалент міді k, кг/Кл
-3
20*10
-3
22*10
-3
2*10
4
1500
-7
3.33*10
Таблиця
Слайд #12
Розрахунки
m=K*I*t
K=m/It
-7
K=0.002кг/4А* 1500с=3.3*10 кг/Кл
В результаті виконаної роботи перевірено закон електролізу на практиці та зроблені розрахунки електрохімічного еквіваленту міді, який в мене майже співпав з табличними даними.
m=K*I*t
K=m/It
-7
K=0.002кг/4А* 1500с=3.3*10 кг/Кл
В результаті виконаної роботи перевірено закон електролізу на практиці та зроблені розрахунки електрохімічного еквіваленту міді, який в мене майже співпав з табличними даними.

Слайд #13
Висновок:
Електролітом називають речовину, розчин якої проводить електричний струм
Розпад молекул на іони називають елекролітичною дисоціацією
Процес виділення речовини на електродах під час проходження електричного струму через електроліт називають електролізом
Маса речовини, що виділилася на електроді при проходженні електричного струму, пропорційна заряду, що пройшов через електроліт m=k*g
Електролітом називають речовину, розчин якої проводить електричний струм
Розпад молекул на іони називають елекролітичною дисоціацією
Процес виділення речовини на електродах під час проходження електричного струму через електроліт називають електролізом
Маса речовини, що виділилася на електроді при проходженні електричного струму, пропорційна заряду, що пройшов через електроліт m=k*g

Слайд #14
Застосування в природі та техніці
Електроліз широко застосовують:
- у промисловості для одержання найбільш активних металів (К, Na, Ca, Mg, Al) і найбільш активних неметалів (фтор і хлор).
- у гальванотехніці ― електролітичному осадженні металів на поверхню металевих і неметалевих виробів, це дозволяє знімати з різних предметів точні копії, які легко відокремити від оригіналу. Такий метод репродукування називають гальванопластикою.
Електроліз використовують:
- для синтезу деяких складних речовин — їдкого натру (NaOH), їдкого калію (KOH), бертолетової солі (KClO3)
- для покриття поверхні металевих виробів шаром більш стійкого металу з метою захисту від корозії, наприклад цинкування, хромування, нікелювання. Шляхом електролізу метали можна очищувати від домішок.
Електроліз широко застосовують:
- у промисловості для одержання найбільш активних металів (К, Na, Ca, Mg, Al) і найбільш активних неметалів (фтор і хлор).
- у гальванотехніці ― електролітичному осадженні металів на поверхню металевих і неметалевих виробів, це дозволяє знімати з різних предметів точні копії, які легко відокремити від оригіналу. Такий метод репродукування називають гальванопластикою.
Електроліз використовують:
- для синтезу деяких складних речовин — їдкого натру (NaOH), їдкого калію (KOH), бертолетової солі (KClO3)
- для покриття поверхні металевих виробів шаром більш стійкого металу з метою захисту від корозії, наприклад цинкування, хромування, нікелювання. Шляхом електролізу метали можна очищувати від домішок.

Слайд #15
Дякую за увагу
