- Головна
- Готові шкільні презентації
- Презентація на тему «Білки та Амінокислоти»
Презентація на тему «Білки та Амінокислоти»
231
Слайд #1
Презентація по темі«Білки та Амінокислоти»
Слайд #2
Білки
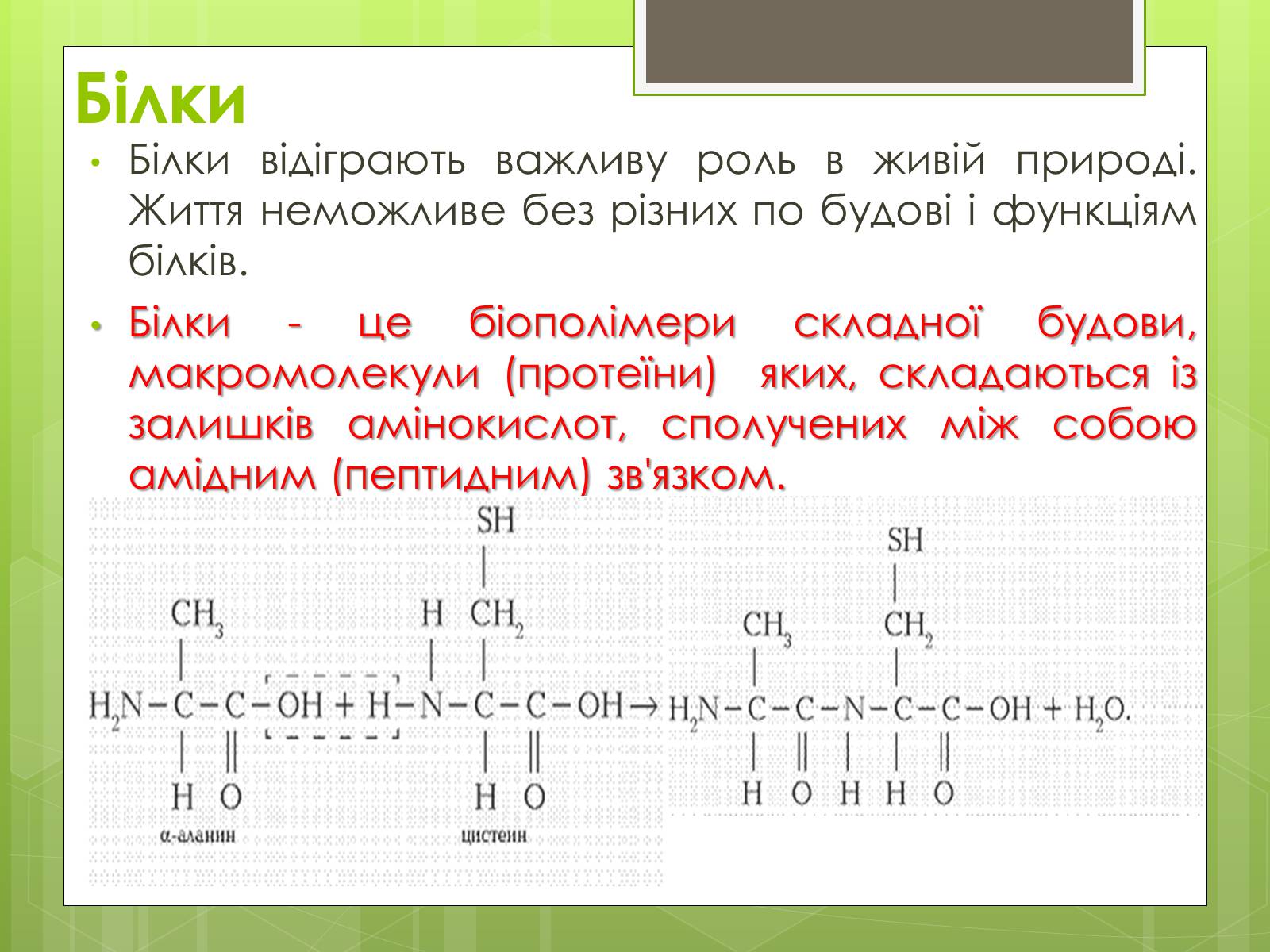
Білки відіграють важливу роль в живій природі. Життя неможливе без різних по будові і функціям білків.
Білки - це біополімери складної будови, макромолекули (протеїни) яких, складаються із залишків амінокислот, сполучених між собою амідним (пептидним) зв'язком.
Білки відіграють важливу роль в живій природі. Життя неможливе без різних по будові і функціям білків.
Білки - це біополімери складної будови, макромолекули (протеїни) яких, складаються із залишків амінокислот, сполучених між собою амідним (пептидним) зв'язком.
Слайд #3
Білки відіграють важливу роль в життєдіяльності всіх організмів. При травленні білкові молекули перетравлюються до амінокислот, які, добре розчинні у водному середовищі, проникають в кров і надходять до всіх тканин і клітин організму. Тут найбільша частина амінокислот витрачається на синтез білків різних органів і тканин, частину на синтез гормонів, ферментів і інших біологічно важливих речовин, а останні служать як енергетичний матеріал.
Тобто білки виконують каталітичні (ферменти), регуляторні (гормони), транспортні (гемоглобін, міоглобін і ін.), захисні (антитіла, тромбін і ін.) функції.
Тобто білки виконують каталітичні (ферменти), регуляторні (гормони), транспортні (гемоглобін, міоглобін і ін.), захисні (антитіла, тромбін і ін.) функції.

Слайд #4
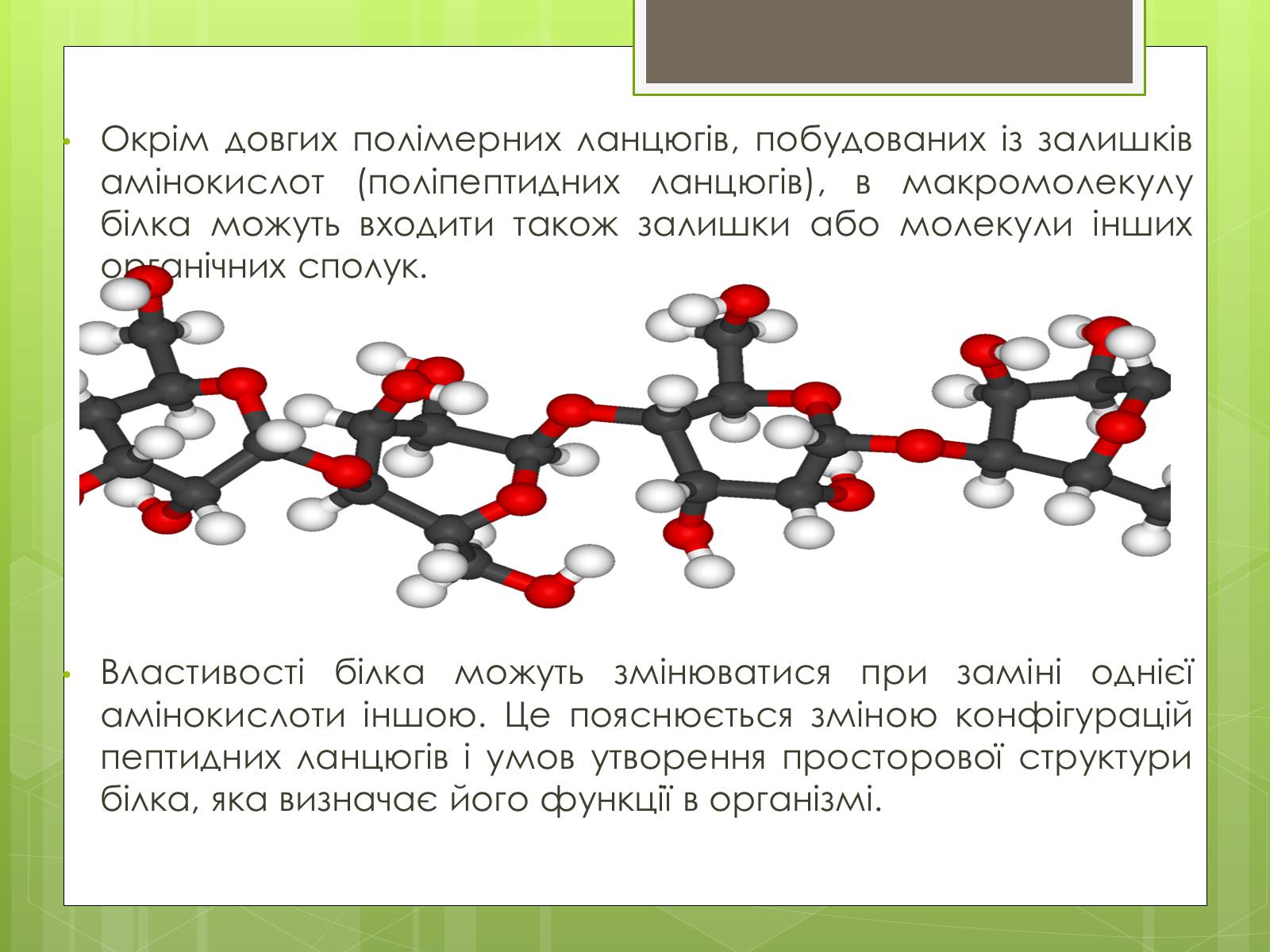
Окрім довгих полімерних ланцюгів, побудованих із залишків амінокислот (поліпептидних ланцюгів), в макромолекулу білка можуть входити також залишки або молекули інших органічних сполук.
Властивості білка можуть змінюватися при заміні однієї амінокислоти іншою. Це пояснюється зміною конфігурацій пептидних ланцюгів і умов утворення просторової структури білка, яка визначає його функції в організмі.
Властивості білка можуть змінюватися при заміні однієї амінокислоти іншою. Це пояснюється зміною конфігурацій пептидних ланцюгів і умов утворення просторової структури білка, яка визначає його функції в організмі.
Слайд #5
КЛАСИФІКАЦІЯ БІЛКІВ
Білки підрозділяються на дві великі групи: прості білки, або протеїни, і складні білки, або протеїди.
ПРОТЕЇНИ:
Альбумін добре розчиняється у воді. Зустрічаються в молоці, яєчному білку і крові.
Глобуліни у воді не розчиняються, але розчиняються в розбавлених розчинах солей. До глобулінів належать глобуліни крові і м'язовий білок міозин.
Глутеліни розчиняються лише в розбавлених розчинах лугів. Зустрічаються в рослинах.
Склеропротеїни — нерозчинні білки. До склеропротеїнів відносяться кератини, білок шкіри і сполучних тканин колаген, білок натурального шовку фіброїн.
Білки підрозділяються на дві великі групи: прості білки, або протеїни, і складні білки, або протеїди.
ПРОТЕЇНИ:
Альбумін добре розчиняється у воді. Зустрічаються в молоці, яєчному білку і крові.
Глобуліни у воді не розчиняються, але розчиняються в розбавлених розчинах солей. До глобулінів належать глобуліни крові і м'язовий білок міозин.
Глутеліни розчиняються лише в розбавлених розчинах лугів. Зустрічаються в рослинах.
Склеропротеїни — нерозчинні білки. До склеропротеїнів відносяться кератини, білок шкіри і сполучних тканин колаген, білок натурального шовку фіброїн.

Слайд #6
Протеїди побудовані з протеїнів, сполучених з молекулами іншого типу.
Фосфопротеїди містять молекули фосфорної кислоти, зв'язану у вигляді складного ефіру в гідроксильної групи амінокислоти серину. До них відноситься вітелінбілок, що міститься в яєчному жовтку, білок молока казеїн.
Глікопротеїди містять залишки вуглеводів. Вони входять до складу хрящів, рогів, слини.
Хромопротеїди містять молекулу забарвленої речовини, зазвичай типа порфіну. Найважливішим хромопротєїдом є гемоглобін — переносник кисню, що надає забарвлення червоним кров'яним тільцям.
Нуклеопротеїди — пов'язані з нуклеїновими кислотами. Вони є дуже важливими з біологічної точки зору білками — складовими частинами клітинних ядер. Нуклеопротеїди є важливою складовою частиною вірусів — збудників багатьох хвороб.
Фосфопротеїди містять молекули фосфорної кислоти, зв'язану у вигляді складного ефіру в гідроксильної групи амінокислоти серину. До них відноситься вітелінбілок, що міститься в яєчному жовтку, білок молока казеїн.
Глікопротеїди містять залишки вуглеводів. Вони входять до складу хрящів, рогів, слини.
Хромопротеїди містять молекулу забарвленої речовини, зазвичай типа порфіну. Найважливішим хромопротєїдом є гемоглобін — переносник кисню, що надає забарвлення червоним кров'яним тільцям.
Нуклеопротеїди — пов'язані з нуклеїновими кислотами. Вони є дуже важливими з біологічної точки зору білками — складовими частинами клітинних ядер. Нуклеопротеїди є важливою складовою частиною вірусів — збудників багатьох хвороб.

Слайд #7
Це цікаво
Число амінокислотних залишків, що входять в молекули окремих білків, дуже різне: у інсуліні 51, в міоглобіні - близько 140. Тому і відносна молекулярна маса білків коливається в дуже широких межах - від 10 тисяч до багатьох мільйонів. На основі визначення відносної молекулярної маси і елементарного аналізу встановлена емпірична формула білкової молекули - гемоглобіну крові (C738Н1166О208S2Fe)4. Менша молекулярна маса може бути в простих ферментів і деяких гормонів білкової природи. Наприклад, молекулярна маса гормону інсуліну близько 6500, а білка вірусу грипу — 320 000 000.
Число амінокислотних залишків, що входять в молекули окремих білків, дуже різне: у інсуліні 51, в міоглобіні - близько 140. Тому і відносна молекулярна маса білків коливається в дуже широких межах - від 10 тисяч до багатьох мільйонів. На основі визначення відносної молекулярної маси і елементарного аналізу встановлена емпірична формула білкової молекули - гемоглобіну крові (C738Н1166О208S2Fe)4. Менша молекулярна маса може бути в простих ферментів і деяких гормонів білкової природи. Наприклад, молекулярна маса гормону інсуліну близько 6500, а білка вірусу грипу — 320 000 000.

Слайд #8
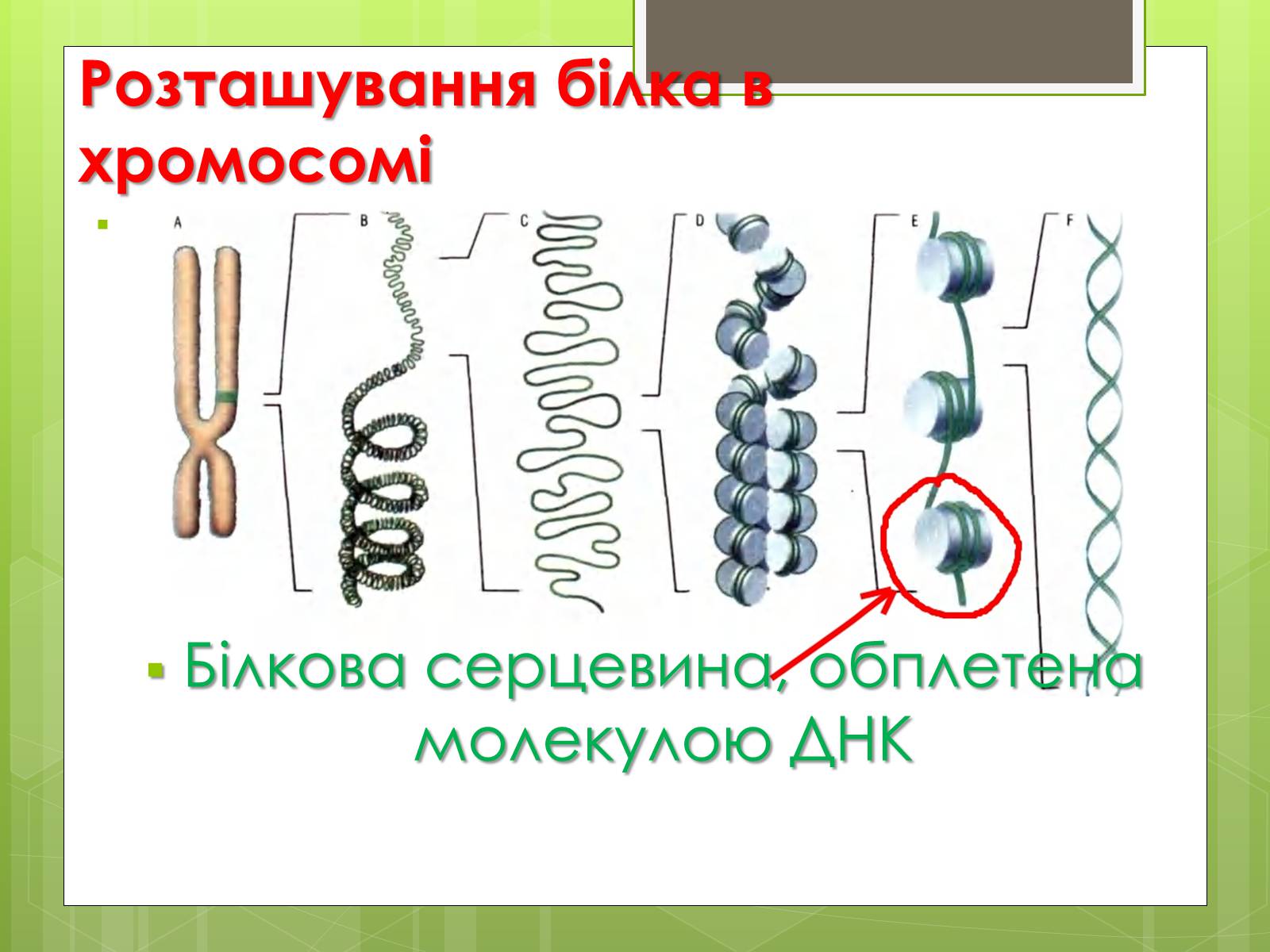
Розташування білка в хромосомі
Білкова серцевина, обплетена молекулою ДНК
Білкова серцевина, обплетена молекулою ДНК
Слайд #9
Сьогодні людина вже глибоко пізнала механізми біосинтезу білка і приступила до штучного отримання найважливіших білків на основі тих же принципів, які досконало відпрацьовані в процесі розвитку органічного світу.
Виявилось, що, розмножуючись на відповідному поживному середовищі, деякі мікроорганізми можуть створювати велику білкову масу. Штучне здобуття білка було актуальним питанням вже в минулому столітті, коли стало зрозуміло, що білки побудовані з амінокислот за допомогою амідних (пептидних) зв'язків. Перші синтези низькомолекулярних пептидів пов'язані з ім'ям німецького хіміка Е. Фішера. У 1903—1907 рр. Е. Фішер синтезував поліпептид, що складається з 19 залишків амінокислот.
Виявилось, що, розмножуючись на відповідному поживному середовищі, деякі мікроорганізми можуть створювати велику білкову масу. Штучне здобуття білка було актуальним питанням вже в минулому столітті, коли стало зрозуміло, що білки побудовані з амінокислот за допомогою амідних (пептидних) зв'язків. Перші синтези низькомолекулярних пептидів пов'язані з ім'ям німецького хіміка Е. Фішера. У 1903—1907 рр. Е. Фішер синтезував поліпептид, що складається з 19 залишків амінокислот.

Слайд #10
Амінокислоти

Слайд #11
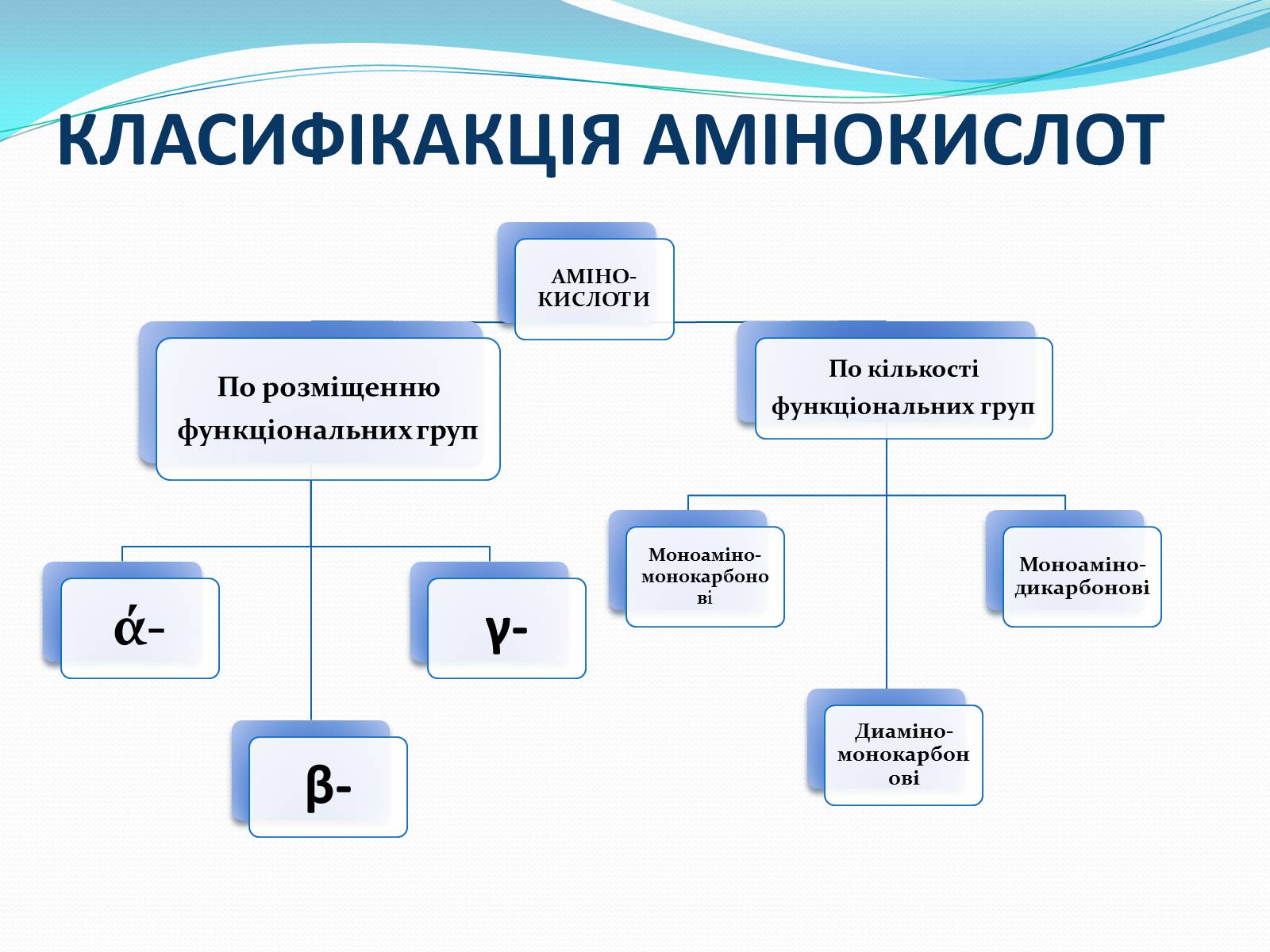
КЛАСИФІКАКЦІЯ АМІНОКИСЛОТ
Слайд #12
ЗАГАЛЬНА ФОРМУЛА
Для ά - амінокислот загальна формула має вигляд:
NН2 – СН – СООН
І
R
Для ά - амінокислот загальна формула має вигляд:
NН2 – СН – СООН
І
R

Слайд #13
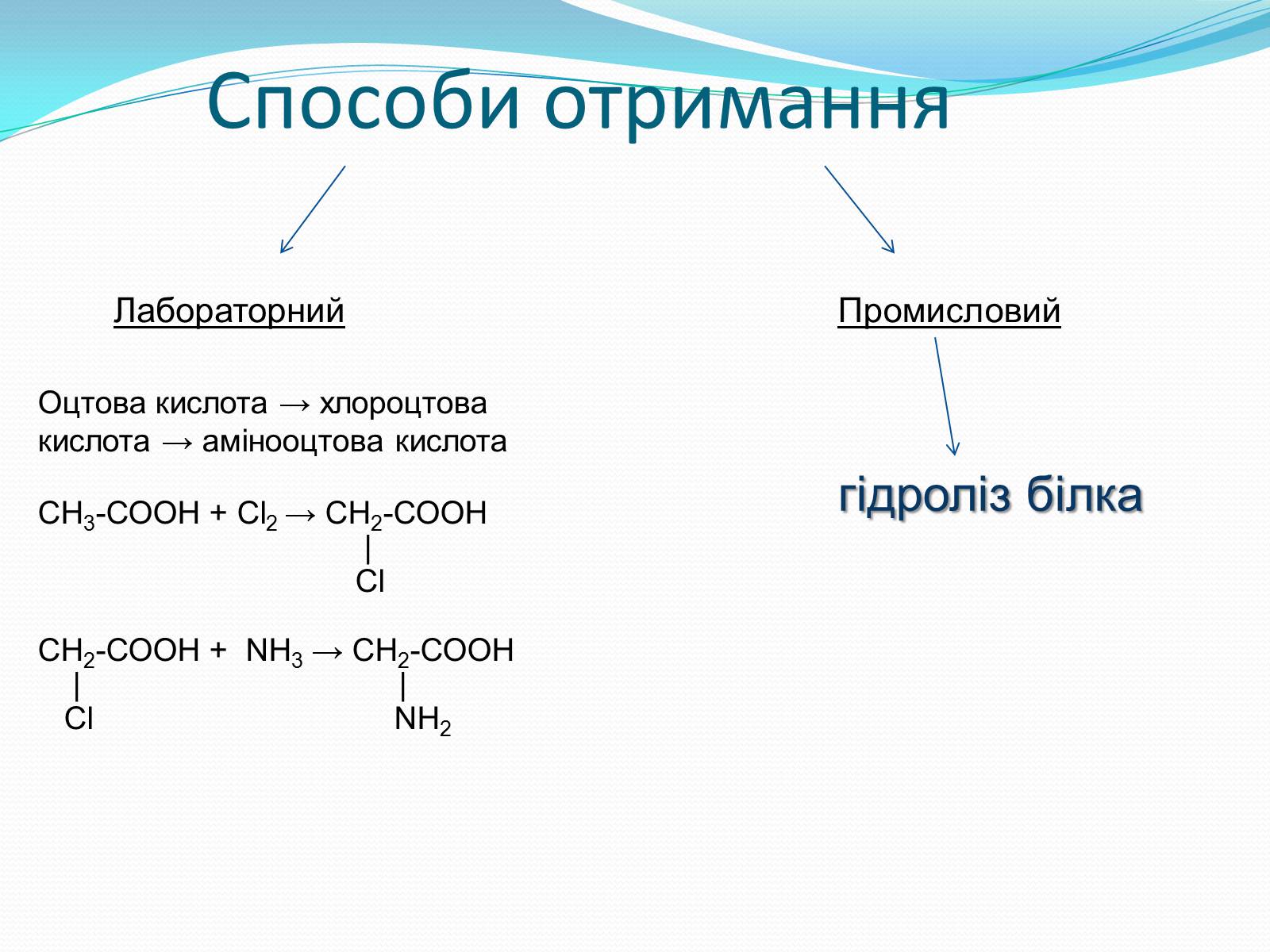
Способи отримання
Лабораторний
Промисловий
Оцтова кислота → хлороцтова кислота → амінооцтова кислота
СН3-СООН + Сl2 → СН2-СООН
|
Cl
СН2-СООН + NH3 → СН2-СООН
| |
Сl NH2
гідроліз білка
Лабораторний
Промисловий
Оцтова кислота → хлороцтова кислота → амінооцтова кислота
СН3-СООН + Сl2 → СН2-СООН
|
Cl
СН2-СООН + NH3 → СН2-СООН
| |
Сl NH2
гідроліз білка
Слайд #14
ФІЗИЧНІ ВЛАСТИВОСТІ
Тверді кристалічні речовини.
Мають високі температури плавлення.
Добре розчиняються у воді.
Мають різний смак: солодкий, гіркий або зовсім без смаку; все залежить від радикала – R в молекулі амінокислоти.
Цим властивостям відповідає структура амінокислот як внутрішніх солей, тому їхні формули часто записують у вигляді біполярного йона:
Н3N⁺-СН2-СОО¯↔Н2N-СН2-СООН
Тверді кристалічні речовини.
Мають високі температури плавлення.
Добре розчиняються у воді.
Мають різний смак: солодкий, гіркий або зовсім без смаку; все залежить від радикала – R в молекулі амінокислоти.
Цим властивостям відповідає структура амінокислот як внутрішніх солей, тому їхні формули часто записують у вигляді біполярного йона:
Н3N⁺-СН2-СОО¯↔Н2N-СН2-СООН

Слайд #15
ХІМІЧНІ ВЛАСТИВОСТІ
Взаємодіють з кислотами:
Н2N-СН2-СООН + НСІ → (Н3N-СН2-СООН)⁺СІ¯
Взаємодіють з лугами:
Н2N-СН2-СООН + NaОН → Н2N-СН2-СООNa + H2O
Взаємодіють між собою:
NH2-CH2-COOH + НNH-CH2-COOH →
→NH2-CH2-CO-NH-CH2-COOH
пептидний
зв'язок
Взаємодіють з кислотами:
Н2N-СН2-СООН + НСІ → (Н3N-СН2-СООН)⁺СІ¯
Взаємодіють з лугами:
Н2N-СН2-СООН + NaОН → Н2N-СН2-СООNa + H2O
Взаємодіють між собою:
NH2-CH2-COOH + НNH-CH2-COOH →
→NH2-CH2-CO-NH-CH2-COOH
пептидний
зв'язок

Слайд #16
Використання амінокислот
Амінокислоти знаходять широке застосування в якості харчових добавок. Наприклад, на лізин, триптофан, треонін і метіоніном збагачують корми сільськогосподарських тварин, додавання натрієвої солі глутамінової кислоти (глутамату натрію) надає ряду продуктів м'ясний смак.
Амінокислоти знаходять широке застосування в якості харчових добавок. Наприклад, на лізин, триптофан, треонін і метіоніном збагачують корми сільськогосподарських тварин, додавання натрієвої солі глутамінової кислоти (глутамату натрію) надає ряду продуктів м'ясний смак.

Слайд #17
У суміші або окремо амінокислоти застосовують у медицині , у тому числі при порушеннях обміну речовин і захворюваннях органів травлення , при деяких захворюваннях центральної нервової системи ( γ - аміномасляна і глутамінова кислоти , ДОФА ) .
Амінокислоти використовуються при виготовленні лікарських препаратів , барвників , в парфумерної промисловості , у виробництві миючих засобів , синтетичних волокон і плівки і т. д.
Для господарських та медичних потреб амінокислоти отримують за допомогою мікроорганізмів шляхом так званого мікробіологічного синтезу (лізин , триптофан , треонін ) ; їх виділяють також з гідролізатів природних білків ( пролін , цистеїн , аргінін , гістидин ) . Але найбільш перспективні змішані способи отримання, що суміщають методи хімічного синтезу та іспользованіеферментов .
Амінокислоти використовуються при виготовленні лікарських препаратів , барвників , в парфумерної промисловості , у виробництві миючих засобів , синтетичних волокон і плівки і т. д.
Для господарських та медичних потреб амінокислоти отримують за допомогою мікроорганізмів шляхом так званого мікробіологічного синтезу (лізин , триптофан , треонін ) ; їх виділяють також з гідролізатів природних білків ( пролін , цистеїн , аргінін , гістидин ) . Але найбільш перспективні змішані способи отримання, що суміщають методи хімічного синтезу та іспользованіеферментов .
