- Головна
- Готові шкільні презентації
- Презентація на тему «Кисень та хімічні властивості кисню»
Презентація на тему «Кисень та хімічні властивості кисню»
1920
Слайд #1
ХІМІЯ
7 клас
Презентація на тему:
“Кисень та хімічні властивості кисню”
7 клас
Презентація на тему:
“Кисень та хімічні властивості кисню”

Слайд #2
К И С Е Н Ь

Слайд #3
К И С Е Н Ь
1 Відкриття кисню
2 Поширення у природі
3 Фізіологічна дія
4 Добування кисню в лабораторії
5 Каталізатори
6 Агрегатний стан та фізичні властивості
7 Хімічні властивості кисню
1 Відкриття кисню
2 Поширення у природі
3 Фізіологічна дія
4 Добування кисню в лабораторії
5 Каталізатори
6 Агрегатний стан та фізичні властивості
7 Хімічні властивості кисню

Слайд #4
Oхygenium - хімічний елемент з атомним номером 8, атомна маса 15,9994. В періодичній системі елементів Менделєєва розташований в другому періоді в групі VIA.У вільному вигляді кисень — газ без кольору, запаху і смаку.
1. Історія відкриття
Історія відкриття кисню, як і азоту, пов'язана з тим, що продовжувалося
декілька століть вивченням атмосферного повітря. Про те, що повітря по своїй
природі не однорідне, а включає частини, одна з яких підтримує горіння і
дихання, а інша — ні, знали ще в 8 столітті китайський алхімік Мао Хоа, а
пізніше в Європі — Леонардо да Вінчі. В 1665 англійський природодослідник
Р. Гук писав, що повітря складається з газу, що міститься в селітрі, а також з
неактивного газу, що становить велику частину повітря. Про те, що повітря
містить елемент, що підтримує життя, в 18 столітті було відоме багатьом
хімікам.
Шведський аптекар і хімік Карл Шєєле почав вивчати склад
повітря в 1768. Протягом трьох років він розкладав нагріванням
селітри (KNO3, NaNO3) і інші речовини і одержував «вогненне повітря», що підтримує дихання і горіння. Але результати своїх дослідів Шєєле обнародував тільки в 1777 році в книзі «Хімічний трактат про повітря і вогонь».
ШЕЄЛЕ (Scheele) Карл Вільгельм (1742-86), шведський хімік, по професії аптекар. Першим отримав багато неорганічних і органічних з'єднань, у тому числі хлор (1774), гліцерин, синильну кислоту (1782), ряд органічних кислот, довів складний склад повітря.
1. Історія відкриття
Історія відкриття кисню, як і азоту, пов'язана з тим, що продовжувалося
декілька століть вивченням атмосферного повітря. Про те, що повітря по своїй
природі не однорідне, а включає частини, одна з яких підтримує горіння і
дихання, а інша — ні, знали ще в 8 столітті китайський алхімік Мао Хоа, а
пізніше в Європі — Леонардо да Вінчі. В 1665 англійський природодослідник
Р. Гук писав, що повітря складається з газу, що міститься в селітрі, а також з
неактивного газу, що становить велику частину повітря. Про те, що повітря
містить елемент, що підтримує життя, в 18 столітті було відоме багатьом
хімікам.
Шведський аптекар і хімік Карл Шєєле почав вивчати склад
повітря в 1768. Протягом трьох років він розкладав нагріванням
селітри (KNO3, NaNO3) і інші речовини і одержував «вогненне повітря», що підтримує дихання і горіння. Але результати своїх дослідів Шєєле обнародував тільки в 1777 році в книзі «Хімічний трактат про повітря і вогонь».
ШЕЄЛЕ (Scheele) Карл Вільгельм (1742-86), шведський хімік, по професії аптекар. Першим отримав багато неорганічних і органічних з'єднань, у тому числі хлор (1774), гліцерин, синильну кислоту (1782), ряд органічних кислот, довів складний склад повітря.

Слайд #5
В 1775 Лавуазье прийшов до висновку, що звичайне повітря
складається з двох газів — газу, необхідного для дихання і
підтримуючого горіння, і газу «протилежного характеру» — азоту.
Лавуазье назвав підтримуючий горіння газ охygene —
«створюючий кислоти» оскільки він тоді вважав, що всі кислоти
містять кисень. Давно вже відомо, що кислоти бувають як
кисневмісними, так і без кисневими, але назва, дана елементу
Лавуазье, залишилася незмінною. Протягом майже півтора століть
1/16 частина маси атома кисню служила одиницею порівняння
мас різних атомів між собою і використовувалася при чисельній
характеристиці мас атомів різних елементів (так звана киснева
шкала атомних мас).
ЛАВУАЗЬЄ (Lavoisier) Антуан Лоран (1743-94), французький хімік, один з основоположників сучасної хімії. Систематично застосовував в хімічних дослідженнях кількісні методи. З'ясував роль кисню в процесах горіння, окислення і дихання (1772-77), ніж спростував теорію флогистона. Один із засновників термохімії. Керував розробкою нової хімічної номенклатури (1786-87). Автор класичного курсу «Початковий підручник хімії» (1789). В 1768-91 генеральний відкупник; під час Французької революції по суду революційного трибуналу в числі інших відкупників гільйотинований.
В 1774 англійський священик і натураліст Дж. Прістлі
нагріванням «паленої ртуті» (оксиду ртуті HgO) отримав газ,
що підтримує горіння. Будучи в Парижі, Прістлі, не знаючий,
що отриманий їм газ входить до складу повітря, повідомив
про своє відкриття.А. Лавуазье і іншим ученим.
ПРІСТЛІ (Priestley) Джозеф (1733-1804), англійський хімік, філософ, прихильник дєізма. В 1794, переслідуваний реакційними кругами, емігрував в США. Іноземний почесний член Петербурзької ан (1780). В творі «Дослідження про матерію і дух» (1777) затверджував, що природа матеріальна, дух — властивість матерії. Розвивав вчення Д. Гартли про асоціації. Відкрив кисень (1774), отримав хлористий водень
складається з двох газів — газу, необхідного для дихання і
підтримуючого горіння, і газу «протилежного характеру» — азоту.
Лавуазье назвав підтримуючий горіння газ охygene —
«створюючий кислоти» оскільки він тоді вважав, що всі кислоти
містять кисень. Давно вже відомо, що кислоти бувають як
кисневмісними, так і без кисневими, але назва, дана елементу
Лавуазье, залишилася незмінною. Протягом майже півтора століть
1/16 частина маси атома кисню служила одиницею порівняння
мас різних атомів між собою і використовувалася при чисельній
характеристиці мас атомів різних елементів (так звана киснева
шкала атомних мас).
ЛАВУАЗЬЄ (Lavoisier) Антуан Лоран (1743-94), французький хімік, один з основоположників сучасної хімії. Систематично застосовував в хімічних дослідженнях кількісні методи. З'ясував роль кисню в процесах горіння, окислення і дихання (1772-77), ніж спростував теорію флогистона. Один із засновників термохімії. Керував розробкою нової хімічної номенклатури (1786-87). Автор класичного курсу «Початковий підручник хімії» (1789). В 1768-91 генеральний відкупник; під час Французької революції по суду революційного трибуналу в числі інших відкупників гільйотинований.
В 1774 англійський священик і натураліст Дж. Прістлі
нагріванням «паленої ртуті» (оксиду ртуті HgO) отримав газ,
що підтримує горіння. Будучи в Парижі, Прістлі, не знаючий,
що отриманий їм газ входить до складу повітря, повідомив
про своє відкриття.А. Лавуазье і іншим ученим.
ПРІСТЛІ (Priestley) Джозеф (1733-1804), англійський хімік, філософ, прихильник дєізма. В 1794, переслідуваний реакційними кругами, емігрував в США. Іноземний почесний член Петербурзької ан (1780). В творі «Дослідження про матерію і дух» (1777) затверджував, що природа матеріальна, дух — властивість матерії. Розвивав вчення Д. Гартли про асоціації. Відкрив кисень (1774), отримав хлористий водень

Слайд #6
Кисень — найпоширеніший на Землі елемент, на його частку (у складі різних з'єднань, головним чином силікатів), доводиться близько 47,4% маси твердої земної кори. Морські і прісні води містять величезну кількість зв'язаного кисню — 88,8% (по масі), в атмосфері зміст вільного кисню складає 20,95 % (за об'ємом). Елемент кисень входить до складу більше 1500 з'єднань земної кори. Кисень в атмосфері Землі почав нагромаджуватися в результаті діяльності первинних фотосинтезуючих організмів, що з'явилися, ймовірно, близько 2,8 млрд. років тому. Вважають, що 2 млрд. років тому атмосфера вже містила близько 1% кисню; поступово з відновної вона перетворювалася на окислювальну і приблизно 400 млн. років тому придбала сучасний склад. Наявність в атмосфері кисню в значній мірі визначила характер біологічної еволюції.
Кисень відіграє особливу роль у природі. Він виступає одночасно і як будівник, і як руйнівник. Окислюючи органічні речовини, кисень підтримує дихання, а отже, й життя. Енергія, що при цьому вивільнюється, забезпечує життєдіяльність організмів. Проте за участю кисню в природі постійно відбуваються і руйнівні процеси: іржавіння металів, горіння речовин, гниття рослинних і тваринних решток.
2 . Поширення у природі
Оксиген 47
Силіцій 27,6
Алюміній 8,8
Решта 1,2
Магній 2,3
Калій 2,4
Ферум 4,7
Кальцій 3,4
Натрій 2,6
Поширення хімічних елементів у земній корі (% за масою)
Кисень відіграє особливу роль у природі. Він виступає одночасно і як будівник, і як руйнівник. Окислюючи органічні речовини, кисень підтримує дихання, а отже, й життя. Енергія, що при цьому вивільнюється, забезпечує життєдіяльність організмів. Проте за участю кисню в природі постійно відбуваються і руйнівні процеси: іржавіння металів, горіння речовин, гниття рослинних і тваринних решток.
2 . Поширення у природі
Оксиген 47
Силіцій 27,6
Алюміній 8,8
Решта 1,2
Магній 2,3
Калій 2,4
Ферум 4,7
Кальцій 3,4
Натрій 2,6
Поширення хімічних елементів у земній корі (% за масою)

Слайд #7
3. Фізіологічна дія
Атмосферний кисень є життєво важливим для всіх живих організмів. Обмін аероба (з участю О2) речовин виник пізніше анаеробного (без участі О2), але саме реакції біологічного окислення, більш ефективні, ніж стародавні енергетичні процеси бродіння забезпечують живі організми переважно необхідної їм енергії. Виняток становлять облігатні анаероби, наприклад, деякі паразити, для яких кисень є отрутою. Використовування кисню, що володіє високим окислювально-відновним потенціалом привело до виникнення біохімічного механізму дихання сучасного типу. Цей механізм і забезпечує енергією організми аеробів.
Кисень — основний біогенний елемент, що входить до складу молекул всіх найважливіших речовин, що забезпечують структуру і функції кліток — білків, нуклеїнових кислот, вуглеводів, ліпідів, а також безлічі низькомолекулярних з'єднань. В кожній рослині або тварині кисню набагато більше, ніж будь-якого іншого елемента (в середньому близько 70%). М'язова тканина людини містить 16% кисню, кісткова тканина — 28.5%; всього в організмі середньої людини (маса тіла 70 кг) міститься 43 кг кисню. В організм тварин і людини кисень поступає в основному через органи дихання (вільний кисень) і з водою (зв'язаний кисень), крізь легені кисень потрапляє у кров, розноситься нею по всьому організму і в клітинах забезпечує перебіг реакцій окиснення. Вони відбуваються з вивільненням енергії, за рахунок якої підтримується стала температура тіла у теплокровних і виконується робота організмами: пересування, робота м'язів та інші життєві процеси. Потреба організму в кисні визначається рівнем (інтенсивністю) обміну речовин, який залежить від маси і поверхні тіла, віку, підлоги, характеру живлення, зовнішніх умов і ін. В екології як важливу енергетичну характеристику визначають відношення сумарного дихання (тобто сумарних окислювальних процесів) співтовариства організмів до його сумарної біомаси. Потрібно, проте, мати на увазі, що тривале вдихання повітря, що збагатило киснем, небезпечно для здоров'я людини. Високі концентрації кисню викликають в тканинах утворення вільних радикалів, що порушують структуру і функції біополімерів. Схожою дією на організм володіють і іонізуючі випромінювання. Тому пониження змісту кисню (гіпоксія) в тканинах і клітках при опромінюванні організму іонізуючою радіацією володіє захисною дією — так званий кисневий ефект. Цей ефект використовують в променевій терапії: підвищуючи вміст кисню в пухлині і знижуючи його вміст в навколишніх тканинах усилюють променеве ураження пухлинних кліток і зменшують пошкодження здорових. При деяких захворюваннях застосовують насичення організму киснем під підвищеним тиском.
Атмосферний кисень є життєво важливим для всіх живих організмів. Обмін аероба (з участю О2) речовин виник пізніше анаеробного (без участі О2), але саме реакції біологічного окислення, більш ефективні, ніж стародавні енергетичні процеси бродіння забезпечують живі організми переважно необхідної їм енергії. Виняток становлять облігатні анаероби, наприклад, деякі паразити, для яких кисень є отрутою. Використовування кисню, що володіє високим окислювально-відновним потенціалом привело до виникнення біохімічного механізму дихання сучасного типу. Цей механізм і забезпечує енергією організми аеробів.
Кисень — основний біогенний елемент, що входить до складу молекул всіх найважливіших речовин, що забезпечують структуру і функції кліток — білків, нуклеїнових кислот, вуглеводів, ліпідів, а також безлічі низькомолекулярних з'єднань. В кожній рослині або тварині кисню набагато більше, ніж будь-якого іншого елемента (в середньому близько 70%). М'язова тканина людини містить 16% кисню, кісткова тканина — 28.5%; всього в організмі середньої людини (маса тіла 70 кг) міститься 43 кг кисню. В організм тварин і людини кисень поступає в основному через органи дихання (вільний кисень) і з водою (зв'язаний кисень), крізь легені кисень потрапляє у кров, розноситься нею по всьому організму і в клітинах забезпечує перебіг реакцій окиснення. Вони відбуваються з вивільненням енергії, за рахунок якої підтримується стала температура тіла у теплокровних і виконується робота організмами: пересування, робота м'язів та інші життєві процеси. Потреба організму в кисні визначається рівнем (інтенсивністю) обміну речовин, який залежить від маси і поверхні тіла, віку, підлоги, характеру живлення, зовнішніх умов і ін. В екології як важливу енергетичну характеристику визначають відношення сумарного дихання (тобто сумарних окислювальних процесів) співтовариства організмів до його сумарної біомаси. Потрібно, проте, мати на увазі, що тривале вдихання повітря, що збагатило киснем, небезпечно для здоров'я людини. Високі концентрації кисню викликають в тканинах утворення вільних радикалів, що порушують структуру і функції біополімерів. Схожою дією на організм володіють і іонізуючі випромінювання. Тому пониження змісту кисню (гіпоксія) в тканинах і клітках при опромінюванні організму іонізуючою радіацією володіє захисною дією — так званий кисневий ефект. Цей ефект використовують в променевій терапії: підвищуючи вміст кисню в пухлині і знижуючи його вміст в навколишніх тканинах усилюють променеве ураження пухлинних кліток і зменшують пошкодження здорових. При деяких захворюваннях застосовують насичення організму киснем під підвищеним тиском.

Слайд #8
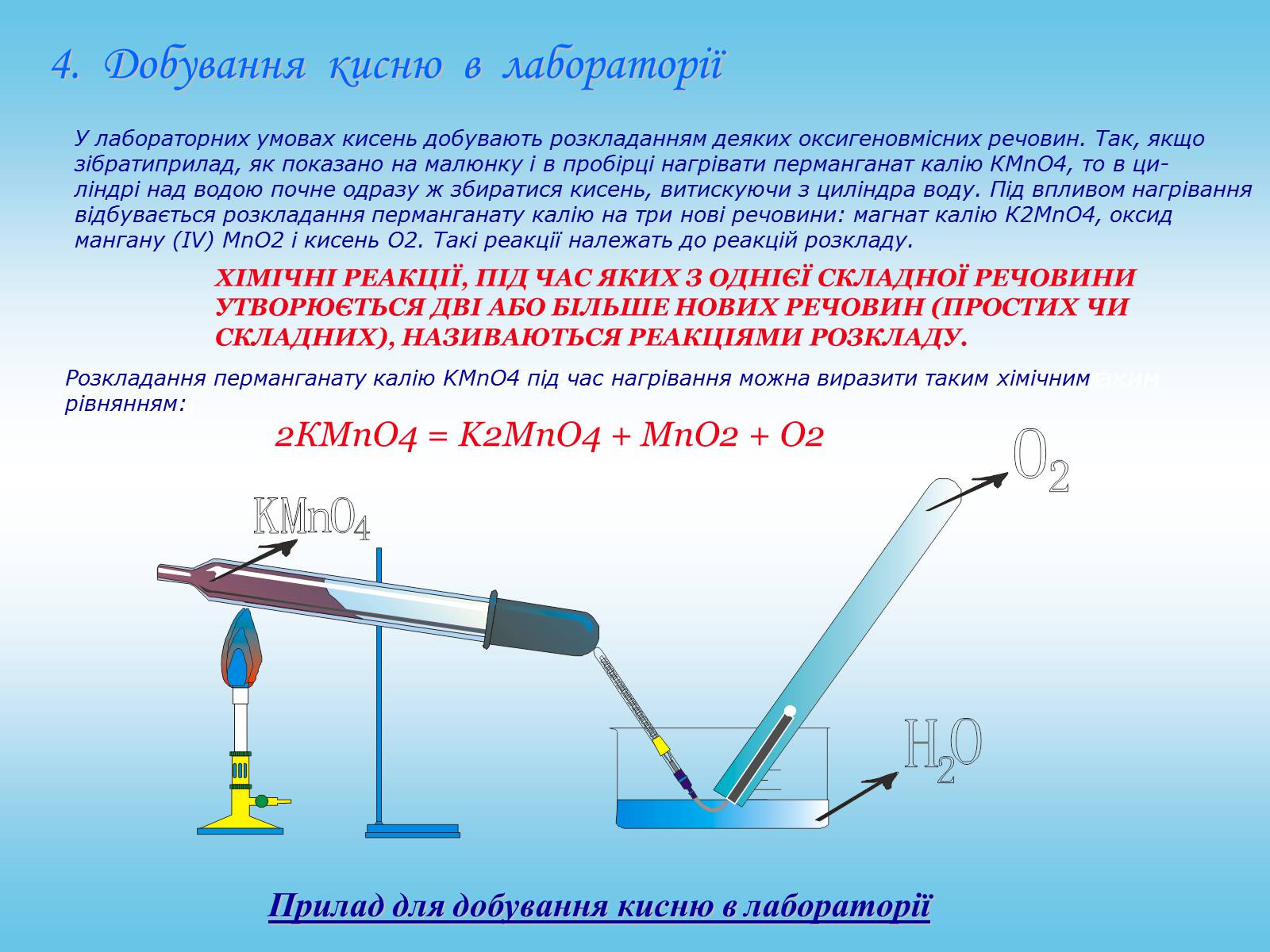
Прилад для добування кисню в лабораторії
4. Добування кисню в лабораторії
У лабораторних умовах кисень добувають розкладанням деяких оксигеновмісних речовин. Так, якщо
зібратиприлад, як показано на малюнку і в пробірці нагрівати перманганат калію КМnO4, то в ци-
ліндрі над водою почне одразу ж збиратися кисень, витискуючи з циліндра воду. Під впливом нагрівання
відбувається розкладання перманганату калію на три нові речовини: магнат калію К2МnO4, оксид
мангану (IV) MnO2 і кисень О2. Такі реакції належать до реакцій розкладу.
ХІМІЧНІ РЕАКЦІЇ, ПІД ЧАС ЯКИХ З ОДНІЄЇ СКЛАДНОЇ РЕЧОВИНИ УТВОРЮЄТЬСЯ ДВІ АБО БІЛЬШЕ НОВИХ РЕЧОВИН (ПРОСТИХ ЧИСКЛАДНИХ), НАЗИВАЮТЬСЯ РЕАКЦІЯМИ РОЗКЛАДУ.
Розкладання перманганату калію КМnO4 під час нагрівання можна виразити таким
хімічним
Розкладання перманганату калію КМnO4 під час нагрівання можна виразити таким хімічним
івнянням:
Розкладання перманганату калію KMnO4 під час нагрівання можна виразити таким хімічним
рівнянням:
2КМnO4 = K2MnO4 + MnO2 + O2
4. Добування кисню в лабораторії
У лабораторних умовах кисень добувають розкладанням деяких оксигеновмісних речовин. Так, якщо
зібратиприлад, як показано на малюнку і в пробірці нагрівати перманганат калію КМnO4, то в ци-
ліндрі над водою почне одразу ж збиратися кисень, витискуючи з циліндра воду. Під впливом нагрівання
відбувається розкладання перманганату калію на три нові речовини: магнат калію К2МnO4, оксид
мангану (IV) MnO2 і кисень О2. Такі реакції належать до реакцій розкладу.
ХІМІЧНІ РЕАКЦІЇ, ПІД ЧАС ЯКИХ З ОДНІЄЇ СКЛАДНОЇ РЕЧОВИНИ УТВОРЮЄТЬСЯ ДВІ АБО БІЛЬШЕ НОВИХ РЕЧОВИН (ПРОСТИХ ЧИСКЛАДНИХ), НАЗИВАЮТЬСЯ РЕАКЦІЯМИ РОЗКЛАДУ.
Розкладання перманганату калію КМnO4 під час нагрівання можна виразити таким
хімічним
Розкладання перманганату калію КМnO4 під час нагрівання можна виразити таким хімічним
івнянням:
Розкладання перманганату калію KMnO4 під час нагрівання можна виразити таким хімічним
рівнянням:
2КМnO4 = K2MnO4 + MnO2 + O2
Слайд #9
5. Каталізатори
Не всі оксигеновмісні речовини під час нагрівання швидко розкладаються з виділенням кисню.
щоб прискорити реакцію, використовують спеціальні речовини. Наприклад, оксид мангану (IV)
MnO2 прискорює розкладання пероксиду гідрогену Н2О2:
MnO2
2H2O2 = 2H2O + O2
Переконаємось у цьому на досліді. Якщо до пероксиду гідрогену в пробірці добавити щіпку
чорного порошку оксиду мангану (IV), то відразу ж відбудеться бурхлива реакція з виділен-
ням кисню, як показано на малюнку. Кисень збирається в посудину за способом витіснення
повітря. Довести, що в посудині кисень, а не повітря, можна за допомогою тліючої скіпки.
Вона спалахує.
О2
MnO2
H2O2
Якщо профільтрувати суміш, то можна відокремити оксид
Мангану (IV) і знову вмістити його в пробірку з новою порцією
пероксиду гідрогену. Ефект буде такий самий. Дослід можна
повторювати знову і знову. Оксид мангану (IV) зберігає свою
властивість прискорювати розкладання деяких речовин.
Він сам при цьому не витрачається і до складу продуктів
реакції не входить. Такі речовини називаються каталізаторами.
КАТАЛІЗАТОРИ- ЦЕ РЕЧОВИНИ, ЯКІ ЗМІНЮЮТЬ
ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ, АЛЕ НЕ ВХОДЯТЬ
ДО СКЛАДУ ІЇ ПРОДУКТІВ.
Каталізатори широко застосовують у промисловості. Вони дають змогу підвищувати продуктивність хімічних процесів, отже, економніше вести виробництво.
Не всі оксигеновмісні речовини під час нагрівання швидко розкладаються з виділенням кисню.
щоб прискорити реакцію, використовують спеціальні речовини. Наприклад, оксид мангану (IV)
MnO2 прискорює розкладання пероксиду гідрогену Н2О2:
MnO2
2H2O2 = 2H2O + O2
Переконаємось у цьому на досліді. Якщо до пероксиду гідрогену в пробірці добавити щіпку
чорного порошку оксиду мангану (IV), то відразу ж відбудеться бурхлива реакція з виділен-
ням кисню, як показано на малюнку. Кисень збирається в посудину за способом витіснення
повітря. Довести, що в посудині кисень, а не повітря, можна за допомогою тліючої скіпки.
Вона спалахує.
О2
MnO2
H2O2
Якщо профільтрувати суміш, то можна відокремити оксид
Мангану (IV) і знову вмістити його в пробірку з новою порцією
пероксиду гідрогену. Ефект буде такий самий. Дослід можна
повторювати знову і знову. Оксид мангану (IV) зберігає свою
властивість прискорювати розкладання деяких речовин.
Він сам при цьому не витрачається і до складу продуктів
реакції не входить. Такі речовини називаються каталізаторами.
КАТАЛІЗАТОРИ- ЦЕ РЕЧОВИНИ, ЯКІ ЗМІНЮЮТЬ
ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ, АЛЕ НЕ ВХОДЯТЬ
ДО СКЛАДУ ІЇ ПРОДУКТІВ.
Каталізатори широко застосовують у промисловості. Вони дають змогу підвищувати продуктивність хімічних процесів, отже, економніше вести виробництво.

Слайд #10
6. Агрегатний стан та фізичні властивості
Кисень – газ, що складається з двухатомних молекул кисню.
Не має запаху і кольору. Густина кисню при 0о С і тиску 1 атм ( 101,325 кПа)
складає 1,43 г/л, що в 1,11 раза більше густини повітря ( зверніть увагу: коли
наводимо значення густини газу, обов'язково варто вказати температуру і
тиск, оскільки від них, як відомо, дуже залежить об'єм даної кількості газу).
Кисень мало розчиняється у воді, при 20о С і атмосферному тиску в 100 об'ємах
води розчиняється 3 об'єми О2 . З підвищенням температури його розчинність
,
як і розчинність усіх газів, зменшується, а зі зниженням температури – збільшується
(наприклад, при 0о С вона складає 5 об'ємів О2 у 100 об'ємах води).
Розчинність кисню, як і всіх інших газів, збільшується з підвищенням тиску і,
навпаки, зменшується при зниженні тиску. Вона приблизно прямо пропорційна тиску
.
При тиску 101,3 кПа і температурі – 183 о С кисень переходить у рідкий стан
( рідкий кисень – рухлива рідина блакитного кольору), а при температурі -219о С-
в сині кристали.
Кисень – газ, що складається з двухатомних молекул кисню.
Не має запаху і кольору. Густина кисню при 0о С і тиску 1 атм ( 101,325 кПа)
складає 1,43 г/л, що в 1,11 раза більше густини повітря ( зверніть увагу: коли
наводимо значення густини газу, обов'язково варто вказати температуру і
тиск, оскільки від них, як відомо, дуже залежить об'єм даної кількості газу).
Кисень мало розчиняється у воді, при 20о С і атмосферному тиску в 100 об'ємах
води розчиняється 3 об'єми О2 . З підвищенням температури його розчинність
,
як і розчинність усіх газів, зменшується, а зі зниженням температури – збільшується
(наприклад, при 0о С вона складає 5 об'ємів О2 у 100 об'ємах води).
Розчинність кисню, як і всіх інших газів, збільшується з підвищенням тиску і,
навпаки, зменшується при зниженні тиску. Вона приблизно прямо пропорційна тиску
.
При тиску 101,3 кПа і температурі – 183 о С кисень переходить у рідкий стан
( рідкий кисень – рухлива рідина блакитного кольору), а при температурі -219о С-
в сині кристали.

Слайд #11
7. Хімічні властивості кисню
Важливо знати, за яких умов відбуваються хімічні реакції, як вони відбуваються і які речовини
Утворюються.
Для цього розглянемо деякі досліди.
1. Горіння фосфору в кисні
1. У посудину з киснем внесемо залізну ложку із запаленим фосфором. Утворюється густий
Білий дим. Це тверді частинки нової речовини – оксиду фосфору (V) . Якщо після закінчення досліду
В посудину внести тліючу скіпку, то виявиться, що кисню в посудині більше немає.
Його атоми в процесі реакції сполучилися з атомами Фосфору й утворили одну нову речовину –
Оксид фосфору (V) Р2О5.
Отже, кисень не просто підтримує горіння, а й бере участь у реакції як вихідна речовина.
Цю реакцію можна виразити таким хімічним рівнянням:
4Р + 5О2 = 2Р2О5
Важливо знати, за яких умов відбуваються хімічні реакції, як вони відбуваються і які речовини
Утворюються.
Для цього розглянемо деякі досліди.
1. Горіння фосфору в кисні
1. У посудину з киснем внесемо залізну ложку із запаленим фосфором. Утворюється густий
Білий дим. Це тверді частинки нової речовини – оксиду фосфору (V) . Якщо після закінчення досліду
В посудину внести тліючу скіпку, то виявиться, що кисню в посудині більше немає.
Його атоми в процесі реакції сполучилися з атомами Фосфору й утворили одну нову речовину –
Оксид фосфору (V) Р2О5.
Отже, кисень не просто підтримує горіння, а й бере участь у реакції як вихідна речовина.
Цю реакцію можна виразити таким хімічним рівнянням:
4Р + 5О2 = 2Р2О5

Слайд #12
2. Покладемо в залізну ложку кусочок деревного вугілля і внесемо у полум'я пальника. Вуглинка розжа-
риться. Якщо цю вуглинку внести в посудину з кисне, як на малюнку, то вона розжариться ще сильніше
і швидко згорить без полум'я й диму, але з виділенням теплоти.
Щоб дізнатися, яка речовина при цьому утворилася, наллємо в посудину вапняну воду. Вона стає кала-
мутною. Це ознака того, що під час горіння вуглинки утворився вуглекислий газ, або оксид карбону
(IV) С
С + О 2 = СО2
У процесі реакції атоми Карбону, що входять до складу вугілля, сполучаються з атомами Оксигену,
Що входять до складу кисню, й утворюється оксид карбону ( IV) СО2. відбувається реакція сполучення.
2. Горіння вугілля в кисні
риться. Якщо цю вуглинку внести в посудину з кисне, як на малюнку, то вона розжариться ще сильніше
і швидко згорить без полум'я й диму, але з виділенням теплоти.
Щоб дізнатися, яка речовина при цьому утворилася, наллємо в посудину вапняну воду. Вона стає кала-
мутною. Це ознака того, що під час горіння вуглинки утворився вуглекислий газ, або оксид карбону
(IV) С
С + О 2 = СО2
У процесі реакції атоми Карбону, що входять до складу вугілля, сполучаються з атомами Оксигену,
Що входять до складу кисню, й утворюється оксид карбону ( IV) СО2. відбувається реакція сполучення.
2. Горіння вугілля в кисні

Слайд #13
3. Горіння сірки в кисні
Внесемо залізну ложку з сіркою у полум'я пальника. Сірка спочатку розплавиться, далі почне горіти. Спостерігається слабке синювате полум'я. Якщо тепер запалену сірку внести в посудину з киснем, як на малюнку, то горіння посилюється, синювате полум'я стає яскравим. При цьому утворюється газ з різким запахом – оксид сульфуру (IV) SO2 і виділяється велика кількість теплоти:
S + O2 = SO2
Внесемо залізну ложку з сіркою у полум'я пальника. Сірка спочатку розплавиться, далі почне горіти. Спостерігається слабке синювате полум'я. Якщо тепер запалену сірку внести в посудину з киснем, як на малюнку, то горіння посилюється, синювате полум'я стає яскравим. При цьому утворюється газ з різким запахом – оксид сульфуру (IV) SO2 і виділяється велика кількість теплоти:
S + O2 = SO2

Слайд #14
4. Горіння заліза в кисні
Якщо до тонкого стального дроту прикріпити сірник, запалити його і швидко опустити в посудину з
Киснем, то від сірника займеться і дріт ( см. мал.). Сталь – це залізо з домішками вуглецу.
Воно згорає, розкидаючи яскраві іскри залізної окалини Fe3O4.
Залізну окалину можна розглядати як подвійний оксид феруму ( ІІ ) і феруму (ІІІ),
II III
або FeO Fe2O3 , в якому Ферум виявляе валентності ІІ і ІІІ.
Горіння заліза в кисні можна подати рівнянням:
3 Fe + 2O2 = Fe3O4
Кисень може взаємодіяти як з неметалами, так і з металами. В усіх випадках його атоми
Сполучаються з атомами металу або неметалу, утворюючи нову речовину.Такі реакції
Називають реакціями сполучення.
Якщо до тонкого стального дроту прикріпити сірник, запалити його і швидко опустити в посудину з
Киснем, то від сірника займеться і дріт ( см. мал.). Сталь – це залізо з домішками вуглецу.
Воно згорає, розкидаючи яскраві іскри залізної окалини Fe3O4.
Залізну окалину можна розглядати як подвійний оксид феруму ( ІІ ) і феруму (ІІІ),
II III
або FeO Fe2O3 , в якому Ферум виявляе валентності ІІ і ІІІ.
Горіння заліза в кисні можна подати рівнянням:
3 Fe + 2O2 = Fe3O4
Кисень може взаємодіяти як з неметалами, так і з металами. В усіх випадках його атоми
Сполучаються з атомами металу або неметалу, утворюючи нову речовину.Такі реакції
Називають реакціями сполучення.

Слайд #15
Реакції сполучення - це такі реакції, в результаті яких з
кількох вихідних речовин ( простих чи складних ) утворюється
одна складна речовина.
Взаємодія речовини з киснем належить до реакцій окислення. В усіх випадках взаємодії
Фосфору, вугілля, сірки, заліза з киснем відбувається процес окиснення й утворюються
Нові речовини – оксиди : Р2О5 , С О2 , Fe3O4 , SO2 .
Оксиди - це складні речовини, утворені двома елементами,
одним з яких обов'язково є Оксиген.
Подібно до фосфору, сірки, вугілля й заліза з киснем сполучається більшість металів
І неметалів. При цьому реакції можуть супроводжуватися горінням.
Горіння - це хімічна реакція , під час якої відбувається
окиснення речовин з виділенням теплоти і світла.
Проте не завжди реакції окиснення супроводжуються горінням. Наприклад,
Мідь під час нагрівання темнішає, оскільки атоми Купруму, сполучаючись з
Атомами Оксигену, утворюють чорний порошок - оксид купруму (ІІ)СuO без горіння
2 Cu + O2 = 2CuO
Отже, кисень хімічно дуже активний, одна з найактив –
ніших простих речовин.
кількох вихідних речовин ( простих чи складних ) утворюється
одна складна речовина.
Взаємодія речовини з киснем належить до реакцій окислення. В усіх випадках взаємодії
Фосфору, вугілля, сірки, заліза з киснем відбувається процес окиснення й утворюються
Нові речовини – оксиди : Р2О5 , С О2 , Fe3O4 , SO2 .
Оксиди - це складні речовини, утворені двома елементами,
одним з яких обов'язково є Оксиген.
Подібно до фосфору, сірки, вугілля й заліза з киснем сполучається більшість металів
І неметалів. При цьому реакції можуть супроводжуватися горінням.
Горіння - це хімічна реакція , під час якої відбувається
окиснення речовин з виділенням теплоти і світла.
Проте не завжди реакції окиснення супроводжуються горінням. Наприклад,
Мідь під час нагрівання темнішає, оскільки атоми Купруму, сполучаючись з
Атомами Оксигену, утворюють чорний порошок - оксид купруму (ІІ)СuO без горіння
2 Cu + O2 = 2CuO
Отже, кисень хімічно дуже активний, одна з найактив –
ніших простих речовин.
