- Головна
- Готові шкільні презентації
- Презентація на тему «Солі» (варіант 2)
Презентація на тему «Солі» (варіант 2)
821
Слайд #1
План:
Основні відомості
Формула
Назви солей
Класифікація
Фізичні властивості
Хімічні властивості
Термічний розклад солей
Добування
Використання
Солі
Основні відомості
Формула
Назви солей
Класифікація
Фізичні властивості
Хімічні властивості
Термічний розклад солей
Добування
Використання
Солі

Слайд #2
Основні відомості:
Со́лі — речовини, до складу молекул яких входять кислотні залишки (аніони), поєднані з катіонами різного походження (атоми металів, металоподібні групи, як NH+4, та ін.). Утворюються солі внаслідок реакції нейтралізації кислот, або основ. Як правило, солі є кристалічними речовинами.
Со́лі — речовини, до складу молекул яких входять кислотні залишки (аніони), поєднані з катіонами різного походження (атоми металів, металоподібні групи, як NH+4, та ін.). Утворюються солі внаслідок реакції нейтралізації кислот, або основ. Як правило, солі є кристалічними речовинами.

Слайд #3
Формула:
Men(зал)m
Me-метал,n m-валентність,зал.-кислотний залишок
Men(зал)m
Me-метал,n m-валентність,зал.-кислотний залишок

Слайд #4
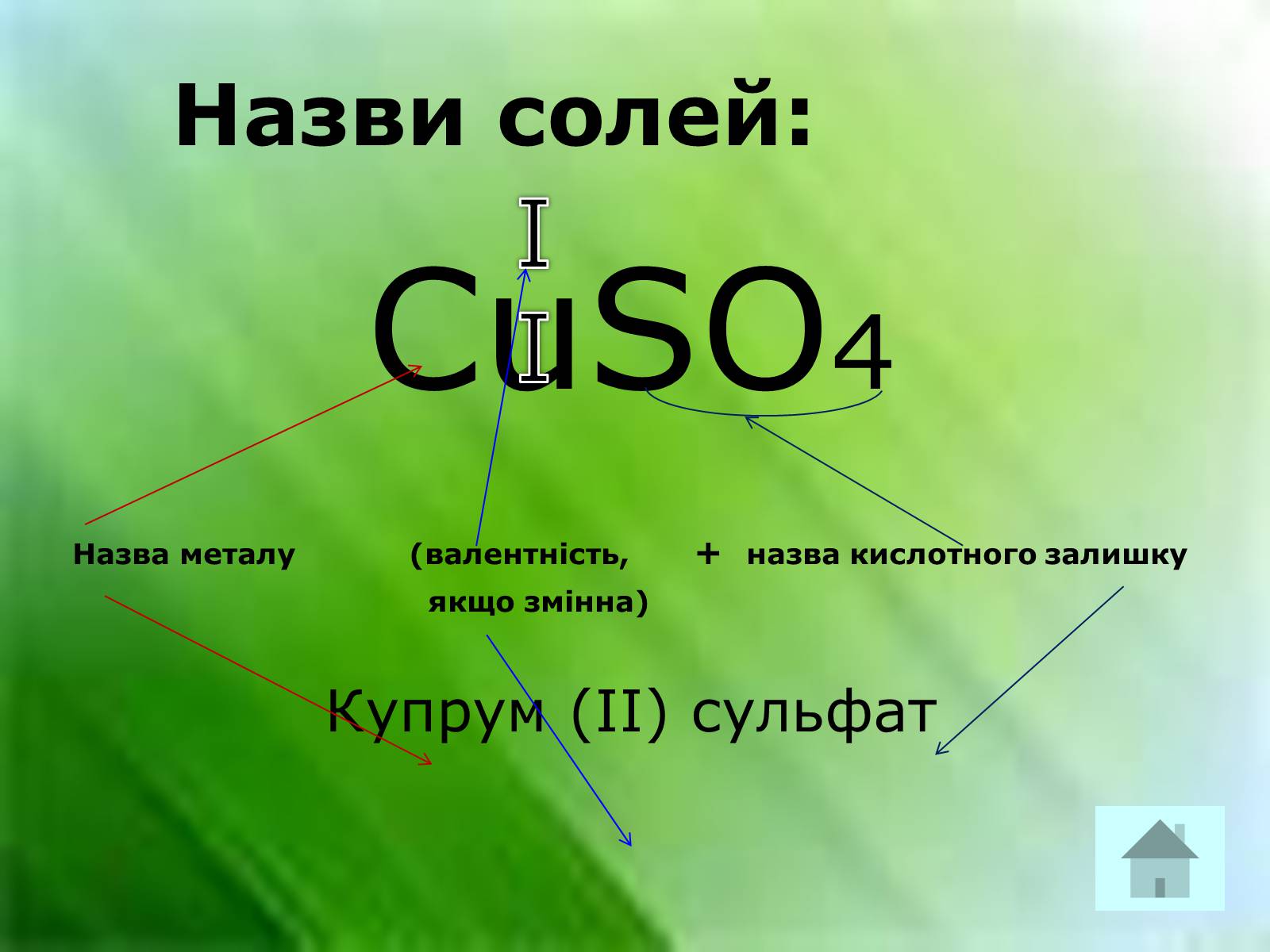
Назви солей:
CuSO4
Назва металу (валентність, + назва кислотного залишку
якщо змінна)
Купрум (ІІ) сульфат
II
CuSO4
Назва металу (валентність, + назва кислотного залишку
якщо змінна)
Купрум (ІІ) сульфат
II
Слайд #5
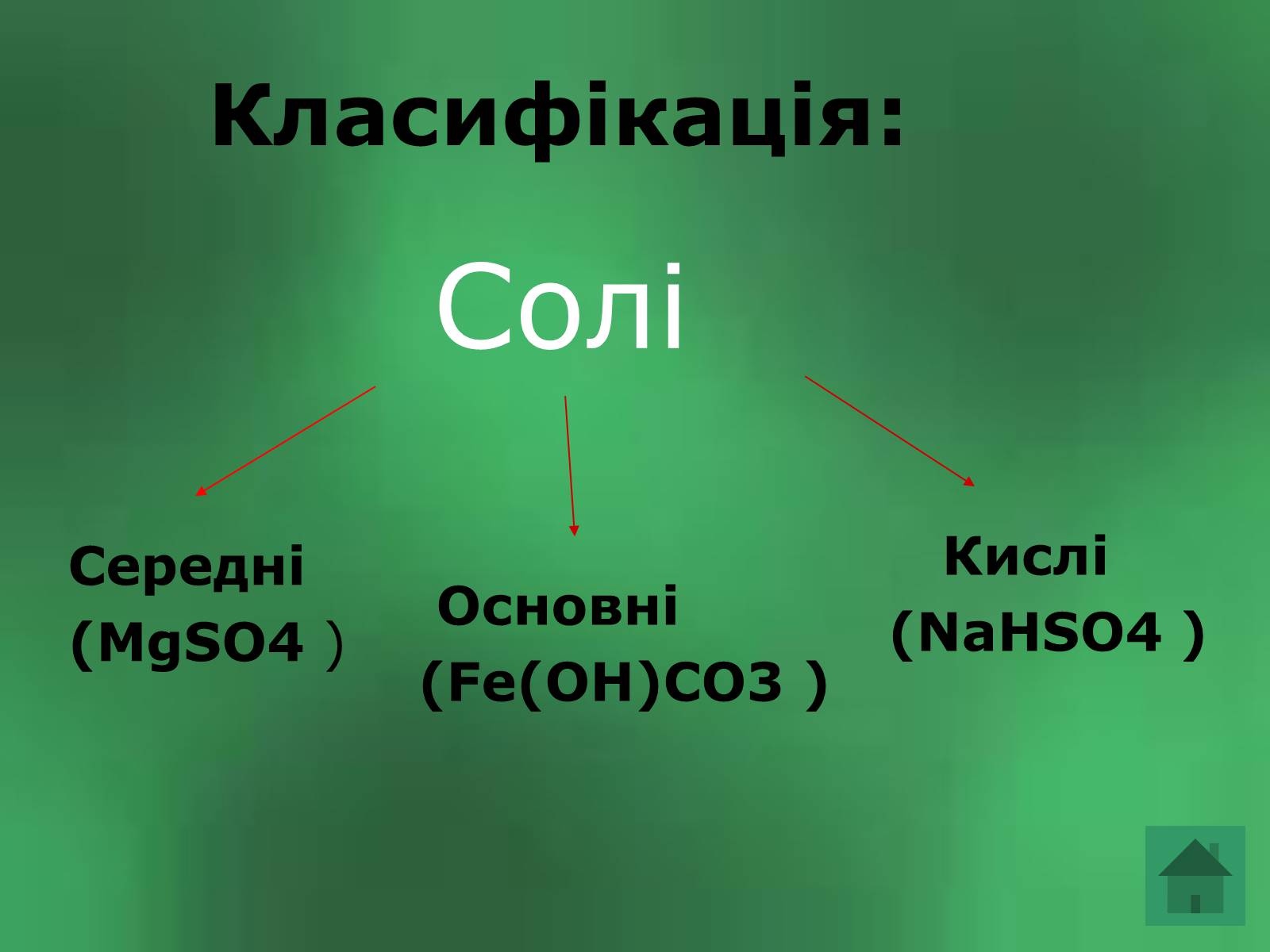
Класифікація:
Солі
Середні
(MgSO4 )
Кислі
(NaHSO4 )
Основні
(Fe(OH)CO3 )
Солі
Середні
(MgSO4 )
Кислі
(NaHSO4 )
Основні
(Fe(OH)CO3 )
Слайд #6
Фізичні властивості:
Солі в основному – тверді кристалічні речовини. Їх можна поділити на розчинні, малорозчинні та практично нерозчинні. Хімічні властивості солей зумовлюються їх відношенням до металів, кислот і солей.
Солі в основному – тверді кристалічні речовини. Їх можна поділити на розчинні, малорозчинні та практично нерозчинні. Хімічні властивості солей зумовлюються їх відношенням до металів, кислот і солей.

Слайд #7
Хімічні властивості:
1.Взаємодія з металами
Ме№1+сіль№1=ме№2+сіль№2
(знаходиться лівіше Н2)
2.Взаємодія з солями
Сіль№1+сіль№2=сіль№3+сіль№4
(р+р=н+р)
3.Взаємодія з лугами
Сіль+луг=основа+сіль
1.Взаємодія з металами
Ме№1+сіль№1=ме№2+сіль№2
(знаходиться лівіше Н2)
2.Взаємодія з солями
Сіль№1+сіль№2=сіль№3+сіль№4
(р+р=н+р)
3.Взаємодія з лугами
Сіль+луг=основа+сіль

Слайд #8
Термічний розклад солей:
Me(NО3)n
лів.Mg Me(NO3)n+O2
Mg-Cu MenOm+NO2+O2
прав.Mg Me+NO2+O2
Me(NО3)n
лів.Mg Me(NO3)n+O2
Mg-Cu MenOm+NO2+O2
прав.Mg Me+NO2+O2

Слайд #9
1. Реакція нейтралізації:
КОН + HNО3 = KNО3 + Н2О
2. Взаємодія кислот з основними оксидами:
CuO + H2SО4 = CuSO4 + Н2О
3. Взаємодія кислот із солями:
ВаСl2 + H2S04 = BaS04u95; + 2НСl
4. Взаємодія кислот з металами:
Mg + 2HCl = MgCl2 + H2u93;
5. Взаємодія двох різних солей:
AgNО3 + КСl = AgClu95; + KNО3
Добування солей:
КОН + HNО3 = KNО3 + Н2О
2. Взаємодія кислот з основними оксидами:
CuO + H2SО4 = CuSO4 + Н2О
3. Взаємодія кислот із солями:
ВаСl2 + H2S04 = BaS04u95; + 2НСl
4. Взаємодія кислот з металами:
Mg + 2HCl = MgCl2 + H2u93;
5. Взаємодія двох різних солей:
AgNО3 + КСl = AgClu95; + KNО3
Добування солей:

Слайд #10
6. Взаємодія солей з металами:
Fe + CuSO4 = FeSО4 + Cu7. Взаємодія солей з лугами:
ЗКОН + FeCl3 = Fe(OH)3u95; + ЗКСl
8. Взаємодія лугів з кислотними оксидами:
Са(ОН)2 + СО2 = СаСО3 + Н2О9. Взаємодія основних оксидів з кислотними:
СаО + SiО2 = CaSiО3
10. Взаємодія металів із неметалами:
Fe + S = FeS
Fe + CuSO4 = FeSО4 + Cu7. Взаємодія солей з лугами:
ЗКОН + FeCl3 = Fe(OH)3u95; + ЗКСl
8. Взаємодія лугів з кислотними оксидами:
Са(ОН)2 + СО2 = СаСО3 + Н2О9. Взаємодія основних оксидів з кислотними:
СаО + SiО2 = CaSiО3
10. Взаємодія металів із неметалами:
Fe + S = FeS

Слайд #11
Солі соляної кислоти. З хлоридів
найбільше використовують хлорид
натрію і хлорид калію. Хлорид натрію
(кухонну сіль) виділяють з озерної та
морської води, а також
добувають у соляних
шахтах. Кухонну сіль
використовують у їжу. У
промисловості хлорид натрію
служить сировиною для отримання
хлору, гідроксиду натрію і соди.
Хлорид калію використовують у
сільському господарстві як калійне добриво.
Використання:
найбільше використовують хлорид
натрію і хлорид калію. Хлорид натрію
(кухонну сіль) виділяють з озерної та
морської води, а також
добувають у соляних
шахтах. Кухонну сіль
використовують у їжу. У
промисловості хлорид натрію
служить сировиною для отримання
хлору, гідроксиду натрію і соди.
Хлорид калію використовують у
сільському господарстві як калійне добриво.
Використання:

Слайд #12
Солі сірчаної кислоти. У будівництві і в медицині широко використовують напівводний гіпс, одержуваний при випаленні гірської породи (дигідрат сульфату кальцію). Будучи змішаний з водою, він швидко застигає, утворюючи дигідрат сульфату кальцію, тобто гіпс. Декагідрат сульфату натрію використовують в якості сировини для отримання соди.

Слайд #13
Солі азотної кислоти. Нітрати найбільше використовують в якості добрив у сільському господарстві. Найважливішим із них є нітрат натрію, нітрат калію, нітрат кальцію і нітрат амонію. Зазвичай ці солі називають селітрами.

Слайд #14
Солі вугільної кислоти. Карбонат кальцію використовують в якості сировини для отримання вапна.Карбонат натрію (соду) застосовують у виробництві скла і при варінні мила. Карбонат кальцію в природі зустрічається і у вигляді вапняку, крейди і мармуру.
