- Головна
- Готові шкільні презентації
- Презентація на тему «Твердість води» (варіант 2)
Презентація на тему «Твердість води» (варіант 2)
1802
Слайд #1
Презентація на тему:Твердість води
Способи усунення твердості води
Способи усунення твердості води

Слайд #2
Твердість або жорсткість води
якщо вода містить у значній кількості солі:
кальцію (Ca+),
магнію (Mg+),
то таку воду називають твердою
якщо вода містить у значній кількості солі:
кальцію (Ca+),
магнію (Mg+),
то таку воду називають твердою

Слайд #3
Чому тверда вода непридатна для використання?
Тверду воду не можна вживати:
для прання білизни,
миття шерсті,
фарбування тканин.
Тверда вода непридатна і для цілого ряду інших виробництв:
паперового,
шкіряного,
крохмального,
спиртового тощо.
Для приготування їжі тверду воду не вживають, бо в ній погано розварюються м'ясо і овочі.
Для пиття вона теж непридатна.
Тверду воду не можна вживати:
для прання білизни,
миття шерсті,
фарбування тканин.
Тверда вода непридатна і для цілого ряду інших виробництв:
паперового,
шкіряного,
крохмального,
спиртового тощо.
Для приготування їжі тверду воду не вживають, бо в ній погано розварюються м'ясо і овочі.
Для пиття вона теж непридатна.

Слайд #4
Утворення накипу у твердій воді
Тверда вода непридатна майже для всіх галузей виробництва.
При кип'ятінні такої води утворюється накип, який погано проводить тепло, внаслідок чого збільшуються витрати.
Накип викликає інтенсивне руйнування стінок котлів, що може призвести до аварії.
Тверда вода непридатна майже для всіх галузей виробництва.
При кип'ятінні такої води утворюється накип, який погано проводить тепло, внаслідок чого збільшуються витрати.
Накип викликає інтенсивне руйнування стінок котлів, що може призвести до аварії.

Слайд #5
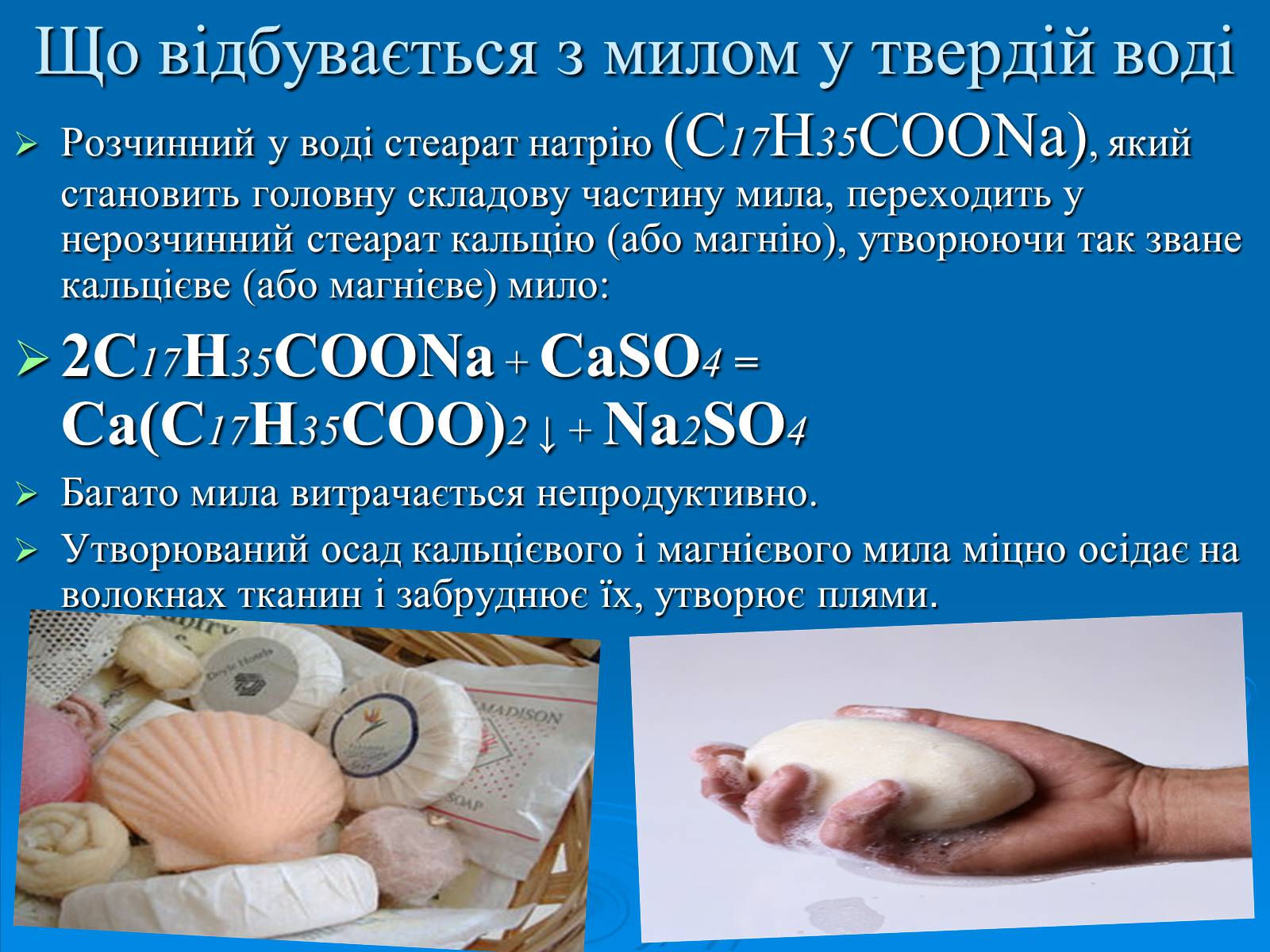
Що відбувається з милом у твердій воді
Розчинний у воді стеарат натрію (С17Н35COONa), який становить головну складову частину мила, переходить у нерозчинний стеарат кальцію (або магнію), утворюючи так зване кальцієве (або магнієве) мило:
2С17Н35COONa + CaSO4 = Са(С17Н35СОО)2 ↓ + Na2SO4
Багато мила витрачається непродуктивно.
Утворюваний осад кальцієвого і магнієвого мила міцно осідає на волокнах тканин і забруднює їх, утворює плями.
Розчинний у воді стеарат натрію (С17Н35COONa), який становить головну складову частину мила, переходить у нерозчинний стеарат кальцію (або магнію), утворюючи так зване кальцієве (або магнієве) мило:
2С17Н35COONa + CaSO4 = Са(С17Н35СОО)2 ↓ + Na2SO4
Багато мила витрачається непродуктивно.
Утворюваний осад кальцієвого і магнієвого мила міцно осідає на волокнах тканин і забруднює їх, утворює плями.
Слайд #6
Тимчасова твердість води:
Обумовлюється наявністю кислих карбонатів (гідрокарбонатів) кальцію і магнію:
Ca(HCO3)2,
Mg(HCO3)2
Обумовлюється наявністю кислих карбонатів (гідрокарбонатів) кальцію і магнію:
Ca(HCO3)2,
Mg(HCO3)2

Слайд #7
Усунення тимчасової твердості
Тимчасову твердість води усувають кип'ятінням:
Ca(HCO3)2 = СаСО3↓ + Н2О + СО2↑
Mg(HCO3)2 = MgСО3↓ + Н2О + СО2↑
Під час нагрівання йони Са2+ і Мg2+ виводяться з розчину у вигляді нерозчинних карбонатів.
Саме легкість усунення тимчасової твердості води під час нагрівання зумовлює назву — «тимчасова».
Тимчасову твердість води усувають кип'ятінням:
Ca(HCO3)2 = СаСО3↓ + Н2О + СО2↑
Mg(HCO3)2 = MgСО3↓ + Н2О + СО2↑
Під час нагрівання йони Са2+ і Мg2+ виводяться з розчину у вигляді нерозчинних карбонатів.
Саме легкість усунення тимчасової твердості води під час нагрівання зумовлює назву — «тимчасова».

Слайд #8
Постійна (стала) твердість води
Постійна твердість води характеризується наявністю сульфатів і хлоридів кальцію і магнію:
CaSO4,
MgSO4,
CaCl2,
MgCl2
Загальна твердість води являє собою суму тимчасової і сталої твердості.
Постійна твердість води характеризується наявністю сульфатів і хлоридів кальцію і магнію:
CaSO4,
MgSO4,
CaCl2,
MgCl2
Загальна твердість води являє собою суму тимчасової і сталої твердості.

Слайд #9
Усунення постійної твердості
Назва «постійна твердість» походить саме від того, що її не можна усунути кипятінням.
Її усувають введенням у воду реагентів —
натрій карбонату (кальцинована сода),
кальцій гідроксиду (вапняна вода),
натрій ортофосфату.
Одночасно усувається як тимчасова, так і постійна, тобто загальна твердість води.
Наприклад:
Ca(HCO3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О
MgSO4 + Na2СО3 = MgСО3↓ + Na2SO4
Ca(HCO3)2 + Na2СО3 = СаСО3↓ + 2NaНСО3
3СаSO4 + 2Na3РО4 = Са3(РО4)2↓ + 3Na2SO4
Назва «постійна твердість» походить саме від того, що її не можна усунути кипятінням.
Її усувають введенням у воду реагентів —
натрій карбонату (кальцинована сода),
кальцій гідроксиду (вапняна вода),
натрій ортофосфату.
Одночасно усувається як тимчасова, так і постійна, тобто загальна твердість води.
Наприклад:
Ca(HCO3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О
MgSO4 + Na2СО3 = MgСО3↓ + Na2SO4
Ca(HCO3)2 + Na2СО3 = СаСО3↓ + 2NaНСО3
3СаSO4 + 2Na3РО4 = Са3(РО4)2↓ + 3Na2SO4

Слайд #10
Сучасний спосіб пом'якшення води
Спосіб заснований на використанні катіонітів.
Катіоніти — це тверді речовини, нерозчинні у воді, до складу яких входять рухливі катіони Na+.
Спрощено їх зображують так: Na2R.
Катіони Na+ можуть обмінюватися на катіони навколишнього середовища, наприклад Са2+ і Mg2+.
Під час пропускання води крізь йонобмінну колонку йони Са2+ і Mg2+ затримуються в ньому, а катіони Na+ переходять у воду:
Na2R + Са2+ = СаR + 2Na+
Спосіб заснований на використанні катіонітів.
Катіоніти — це тверді речовини, нерозчинні у воді, до складу яких входять рухливі катіони Na+.
Спрощено їх зображують так: Na2R.
Катіони Na+ можуть обмінюватися на катіони навколишнього середовища, наприклад Са2+ і Mg2+.
Під час пропускання води крізь йонобмінну колонку йони Са2+ і Mg2+ затримуються в ньому, а катіони Na+ переходять у воду:
Na2R + Са2+ = СаR + 2Na+

Слайд #11
М'яка вода
Коли у воді солей зовсім немає, або вони містяться в незначних кількостях, то вода — м'яка.
Її можна використовувати на будь-якому виробництві.
Така вода безпечна для пиття.
Коли у воді солей зовсім немає, або вони містяться в незначних кількостях, то вода — м'яка.
Її можна використовувати на будь-якому виробництві.
Така вода безпечна для пиття.

Слайд #12
Дякую за увагу !
Презентацію підготував – Максьома Микола
Презентацію підготував – Максьома Микола
