- Головна
- Готові шкільні презентації
- Презентація на тему «Лужні, лужноземельні метали та магній»
Презентація на тему «Лужні, лужноземельні метали та магній»
726
Слайд #1
?

Слайд #2
«Лужні, лужноземельні метали та магній».
Урок в 10 класі КЗ Верхівцевського НВК
Учитель Кукса Н.М.
Урок в 10 класі КЗ Верхівцевського НВК
Учитель Кукса Н.М.

Слайд #3
1.Узагальнити і систематизувати знання про лужні та лужноземельні метали. 2.Вміти характеризувати елементи за положенням в періодичній таблиці. 3.Знати фізичні і хімічні властивості . 4.Вміти пояснити біологічну роль елементів та значеня в промисловості.5.Захист довкілля від шкідливого впливу мийних засобів.4. 4.
Цілепокладання:
Цілепокладання:

Слайд #4
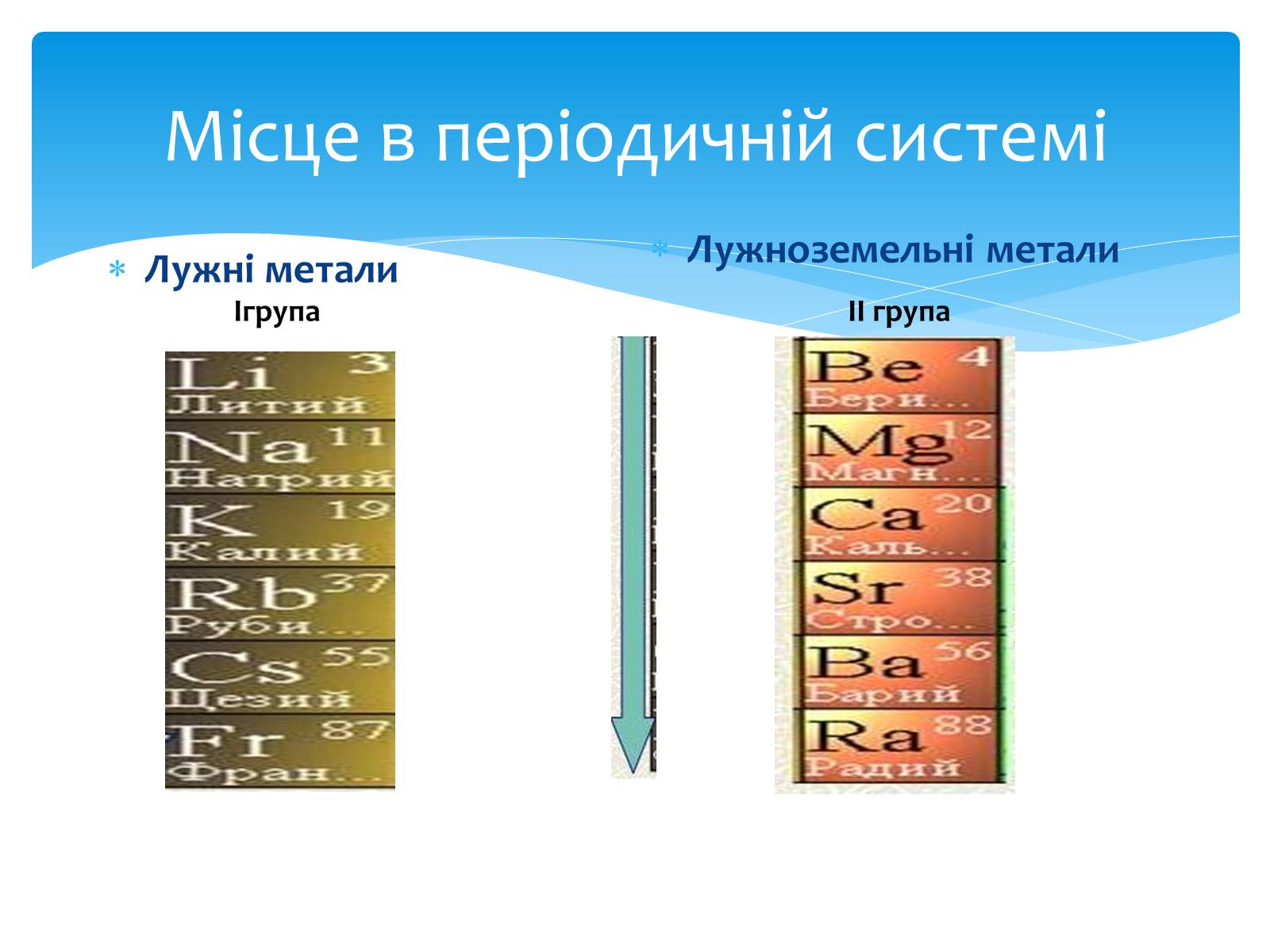
Місце в періодичній системі
Лужні метали
Лужноземельні метали
Ігрупа
ІІ група
Лужні метали
Лужноземельні метали
Ігрупа
ІІ група
Слайд #5
1Чим пояснити активність металів?2.Чому на вашу думку їх називають лужні та лужноземельні?

Слайд #6
Фізичні властивості
Лужні метали
Лужні метали — м'які (натрій ріжеться ножем, як вершкове масло, інші трохи жорсткіші) метали від сріблисто-білого до сірого кольору з характерним блиском, що дуже швидко тьмяніють на повітрі.
Легкоплавкі й рухливі. Агресивні, вибухонебезпечні (зберігаються під шаром гасу (керосин))
Лужноземельні метали.
Практично всі ці елементи являють собою тверді речовини сіруватого кольору (принаймні, при нормальних умовах і кімнатній температурі)
Володіють вищими за лужні метали t°пл. і t°кип., потенціалами іонізації, щільністю і твердістю.
Знайдіть у підручнику , які фізичні властивості має магній, чи дуже вони відрізняються від властивостей лужноземельних металів
Лужні метали
Лужні метали — м'які (натрій ріжеться ножем, як вершкове масло, інші трохи жорсткіші) метали від сріблисто-білого до сірого кольору з характерним блиском, що дуже швидко тьмяніють на повітрі.
Легкоплавкі й рухливі. Агресивні, вибухонебезпечні (зберігаються під шаром гасу (керосин))
Лужноземельні метали.
Практично всі ці елементи являють собою тверді речовини сіруватого кольору (принаймні, при нормальних умовах і кімнатній температурі)
Володіють вищими за лужні метали t°пл. і t°кип., потенціалами іонізації, щільністю і твердістю.
Знайдіть у підручнику , які фізичні властивості має магній, чи дуже вони відрізняються від властивостей лужноземельних металів

Слайд #7
7
Колір – блискучий, сріблясто-білий
t пл. = 651°C.
t кип. ≈ 1107°C.
електропровідний
Легкий, густина ρ = 1,74 г/см3
Відносно м'який, пластичний.
Физичні властивості Mg
Колір – блискучий, сріблясто-білий
t пл. = 651°C.
t кип. ≈ 1107°C.
електропровідний
Легкий, густина ρ = 1,74 г/см3
Відносно м'який, пластичний.
Физичні властивості Mg

Слайд #8
Хімічні властивості
Лужні метали
1. Легко реагують із киснем повітря. Літій при окисленні утворює оксид Li2O, решта - перексиди й супероксиди:
4Li + O2 = 2Li2O
4Na + O2 = 2Na2O
4K + O2 = 2K2O
2. Легко й з вибухом реагують із водою:
2Na + 2H2O = 2NaOH + H2
3. Легко реагують із неметалами:
2Na + S = Na2S
2K + Br2 = 2KBr
4. Специфічні властивості:
2К+Н2 =2КН (гідрид калію)
Лужноземельні метали
1.Взаємодіють з простими речовинами:
2Me0 +O2 → 2Me+2O-2
Me0 +H2 → Me+2H2
Me0 +Cl02 → Me+2Cl2
Me0 +S0 → Me+2S-2
Me0 +2HCl → Me+2Cl2 + H2
Me0 +2HOH → Me+2(OH)2 +Н2
Ca2
Sr2+
Ba2+
Лужні метали
1. Легко реагують із киснем повітря. Літій при окисленні утворює оксид Li2O, решта - перексиди й супероксиди:
4Li + O2 = 2Li2O
4Na + O2 = 2Na2O
4K + O2 = 2K2O
2. Легко й з вибухом реагують із водою:
2Na + 2H2O = 2NaOH + H2
3. Легко реагують із неметалами:
2Na + S = Na2S
2K + Br2 = 2KBr
4. Специфічні властивості:
2К+Н2 =2КН (гідрид калію)
Лужноземельні метали
1.Взаємодіють з простими речовинами:
2Me0 +O2 → 2Me+2O-2
Me0 +H2 → Me+2H2
Me0 +Cl02 → Me+2Cl2
Me0 +S0 → Me+2S-2
Me0 +2HCl → Me+2Cl2 + H2
Me0 +2HOH → Me+2(OH)2 +Н2
Ca2
Sr2+
Ba2+

Слайд #9
Відмінні властивості магнію.
4Mg + Fe3O4 = 4MgO + 3Fe
3Mg + Al2O3 = 3Mg O + 2Al
Магнйтермія - відновленням оксидів металів магнієм, яке супроводжується виділенням значної кількості теплоти.
4Mg + Fe3O4 = 4MgO + 3Fe
3Mg + Al2O3 = 3Mg O + 2Al
Магнйтермія - відновленням оксидів металів магнієм, яке супроводжується виділенням значної кількості теплоти.

Слайд #10
Основний характер оксидів та гідроксидів металів.
Ме―Ме2О―МеОН―сіль
Ме―МеО―Ме(ОН)2―сіль
Складіть будь ласка ланцюжки для Li,та Mg
Ме―Ме2О―МеОН―сіль
Ме―МеО―Ме(ОН)2―сіль
Складіть будь ласка ланцюжки для Li,та Mg

Слайд #11
Поширення в природі
У природі лужні елементи трапляються лише у вигляді солей. Найважливішими мінералами Натрію є кам'яна сіль або галіт NaCl, чилійська селітра NaNO3, глауберова сіль або мірабіліт Na2SO4 • 10H2O.
Велика кількість солей Натрію кристалізується при випаровуванні морської води. Масова частка Натрію у земній корі становить 2,6 %.
Калій, як і Натрій, є досить розповсюдженим хімічним елементом. Масова частка Калію в земній корі — 2,5%.
Природні солі Калію :
сильвін KCl,
сильвініт КCl ∙ NaCl
карналіт КCl ∙ MgCl2 ∙ 6H2O
Калій входить до складу польових шпатів і слюди.
Літій досить широко поширений в земній корі
польовий шпат
У природі лужні елементи трапляються лише у вигляді солей. Найважливішими мінералами Натрію є кам'яна сіль або галіт NaCl, чилійська селітра NaNO3, глауберова сіль або мірабіліт Na2SO4 • 10H2O.
Велика кількість солей Натрію кристалізується при випаровуванні морської води. Масова частка Натрію у земній корі становить 2,6 %.
Калій, як і Натрій, є досить розповсюдженим хімічним елементом. Масова частка Калію в земній корі — 2,5%.
Природні солі Калію :
сильвін KCl,
сильвініт КCl ∙ NaCl
карналіт КCl ∙ MgCl2 ∙ 6H2O
Калій входить до складу польових шпатів і слюди.
Літій досить широко поширений в земній корі
польовий шпат

Слайд #12
Поширення в природі
У зв'язку з високою хімічною активністю у вільному стані в природі він не зустрічаються, а тільки у вигляді різних сполук. Деякі з них, як хлорид калію, утворюють потужні родовищ
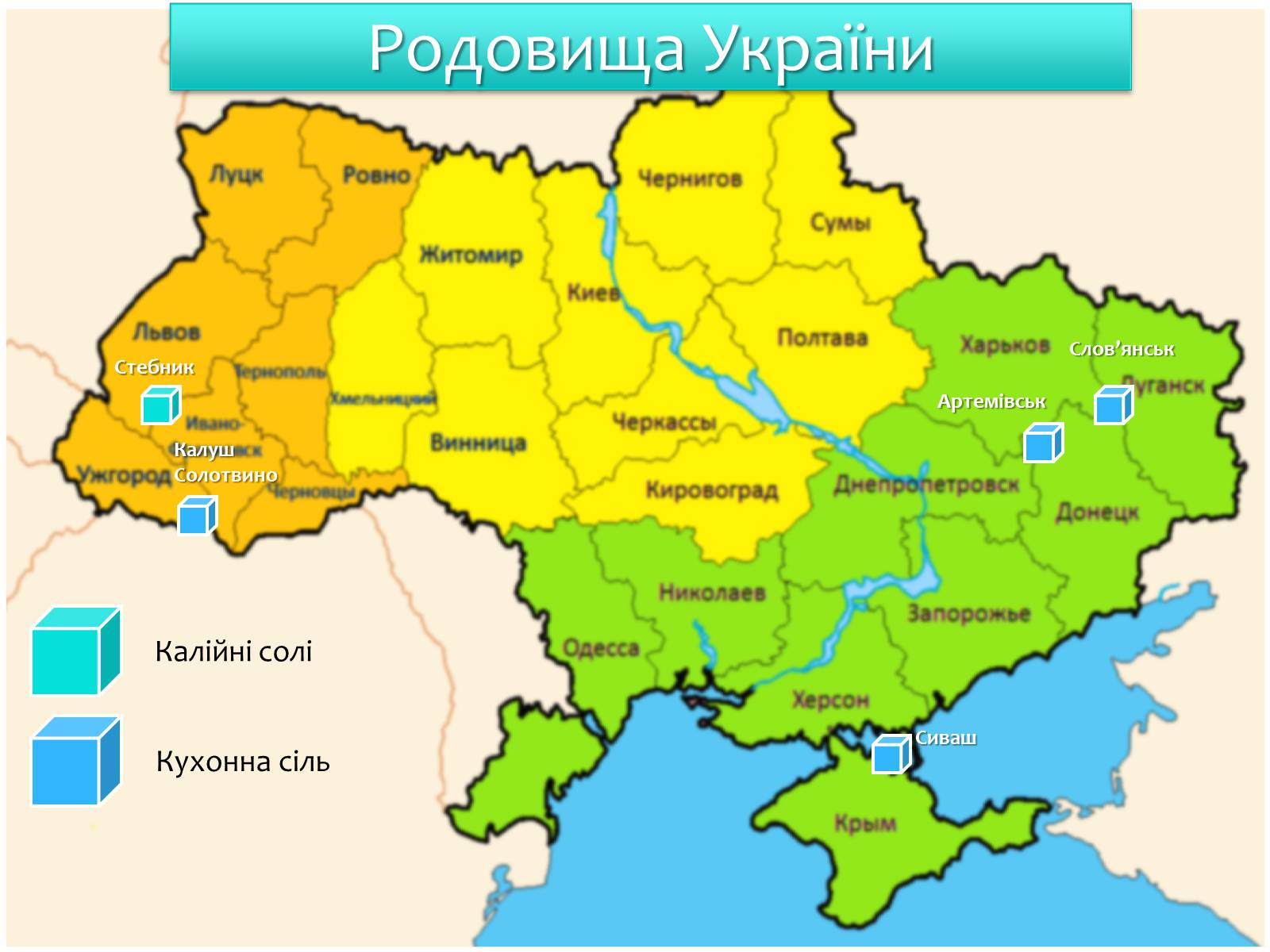
Найбагатші у світі родовища солей калію у вигляді мінералів сильвіну KCl, сильвініту KCl·NaCl, карналіту КCl ∙ MgCl2 ∙ 6H2O і каїніту KCl·MgSO4·3H2O розташовані поблизу м. Солікамська. Крім того, значні поклади сполук калію знайдені в Білорусії (м. Солігорськ) і в Україні (м. Калуш і м. Стебник у Прикарпатті).
хлорид калію
нітрат калію
У зв'язку з високою хімічною активністю у вільному стані в природі він не зустрічаються, а тільки у вигляді різних сполук. Деякі з них, як хлорид калію, утворюють потужні родовищ
Найбагатші у світі родовища солей калію у вигляді мінералів сильвіну KCl, сильвініту KCl·NaCl, карналіту КCl ∙ MgCl2 ∙ 6H2O і каїніту KCl·MgSO4·3H2O розташовані поблизу м. Солікамська. Крім того, значні поклади сполук калію знайдені в Білорусії (м. Солігорськ) і в Україні (м. Калуш і м. Стебник у Прикарпатті).
хлорид калію
нітрат калію

Слайд #13
Родовища України
Калійні солі
Кухонна сіль
Стебник
Калуш
Солотвино
Слов'янськ
Артемівськ
Сиваш
Калійні солі
Кухонна сіль
Стебник
Калуш
Солотвино
Слов'янськ
Артемівськ
Сиваш
Слайд #14
Біологічна роль та використання
сполук калію та натрію
Сколько воды и хлорида натрия нужно взять для приготовления физиологического раствора
массой 0,5 кг?
4,5г соли
495,5 г воды
Смесь хлорида и гидрокарбоната натрия массой 15 г обработали уксусной кислотой, при этом выделилось 2,8 л (н.у.) газа. Определите массовые доли в процентах компонентов смеси.
70% NaHCO3
30% NaCl
Хлорид калия - очень ценное минеральное удобрение. Рассчитайте массовую долю калия (%) в этом веществе.
52%
Тривіальні назви солей:
Поваренная соль
ответ
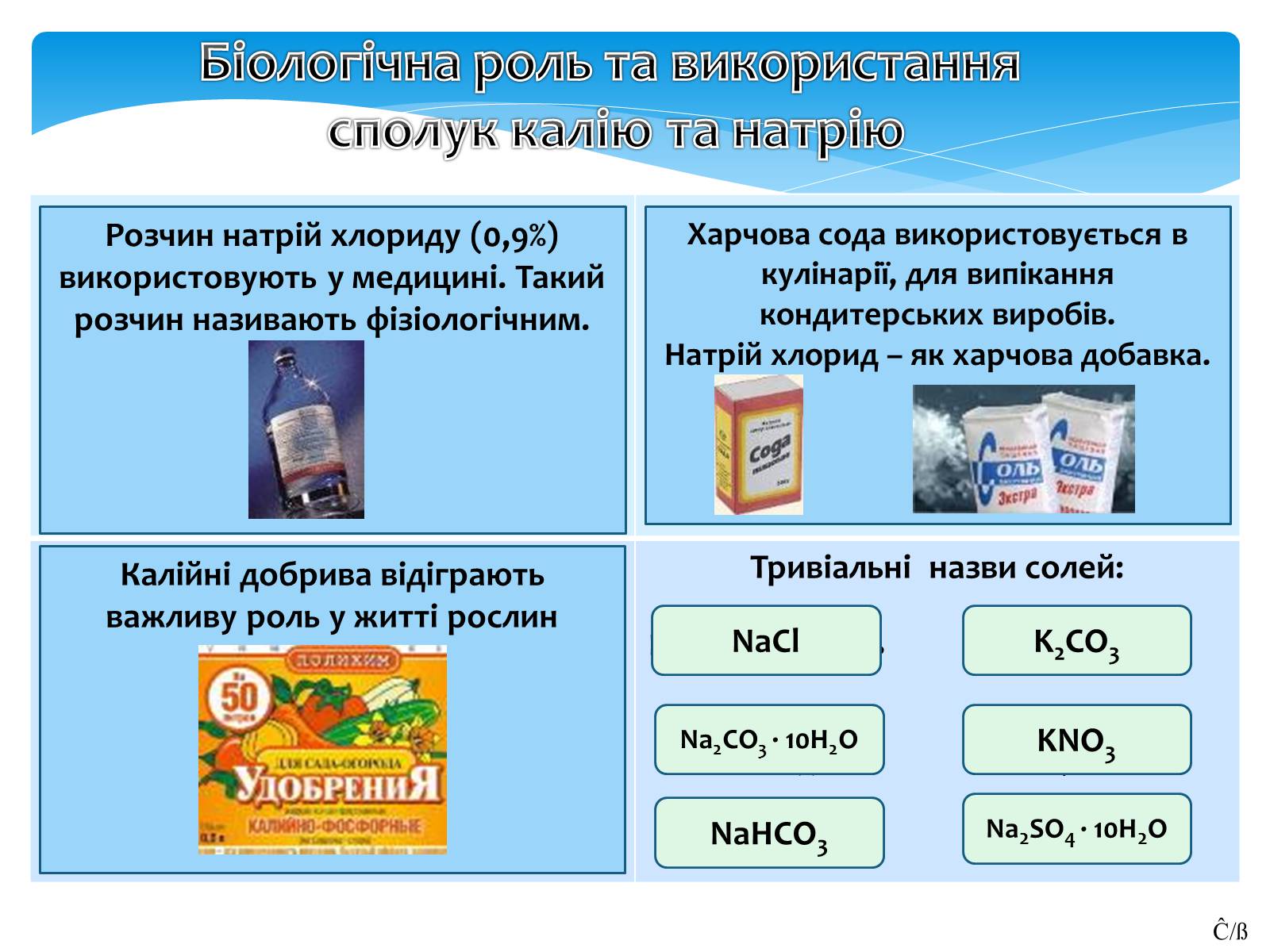
Розчин натрій хлориду (0,9%) використовують у медицині. Такий розчин називають фізіологічним.
ответ
Харчова сода використовується в кулінарії, для випікання кондитерських виробів.
Натрій хлорид – як харчова добавка.
ответ
Калійні добрива відіграють важливу роль у житті рослин
NaCl
Кристалли-ческая сода
Na2CO3 · 10H2O
Питьевая сода
NaHCO3
поташ
K2CO3
Калийная селитра
KNO3
Глауберова соль
Na2SO4 · 10H2O
Ĉ/ß
сполук калію та натрію
Сколько воды и хлорида натрия нужно взять для приготовления физиологического раствора
массой 0,5 кг?
4,5г соли
495,5 г воды
Смесь хлорида и гидрокарбоната натрия массой 15 г обработали уксусной кислотой, при этом выделилось 2,8 л (н.у.) газа. Определите массовые доли в процентах компонентов смеси.
70% NaHCO3
30% NaCl
Хлорид калия - очень ценное минеральное удобрение. Рассчитайте массовую долю калия (%) в этом веществе.
52%
Тривіальні назви солей:
Поваренная соль
ответ
Розчин натрій хлориду (0,9%) використовують у медицині. Такий розчин називають фізіологічним.
ответ
Харчова сода використовується в кулінарії, для випікання кондитерських виробів.
Натрій хлорид – як харчова добавка.
ответ
Калійні добрива відіграють важливу роль у житті рослин
NaCl
Кристалли-ческая сода
Na2CO3 · 10H2O
Питьевая сода
NaHCO3
поташ
K2CO3
Калийная селитра
KNO3
Глауберова соль
Na2SO4 · 10H2O
Ĉ/ß
Слайд #15
Поширення в природі лужноземельних металів.
У зв'язку з високою хімічною активністю у вільному стані в природі вони не зустрічаються, а тільки у вигляді різних сполук. Наприклад:
Гіпс CaSO4∙ 2H2O , барітова каша BaSO4
Апатит Ca3(PO4)2 , вапняк,мармур CaCO3 Вапно Са(ОН)2
Та інші.
У зв'язку з високою хімічною активністю у вільному стані в природі вони не зустрічаються, а тільки у вигляді різних сполук. Наприклад:
Гіпс CaSO4∙ 2H2O , барітова каша BaSO4
Апатит Ca3(PO4)2 , вапняк,мармур CaCO3 Вапно Са(ОН)2
Та інші.

Слайд #16
Поширення Магнию в природі
Брусит
Доломит
Магнезит
Каинит
Карналлит
Брусит
Доломит
Магнезит
Каинит
Карналлит

Слайд #17
Біологічна роль та використання магнію
Магній входить до складу хлорофілу і, отже, відіграє незамінну роль у фотосинтезі і в газообміні планети; загальний вміст магнію в тканинах рослин на Землі за деякими оцінками складає близько 1011 тонн.
Крім хлорофілу, магній у всіх тканинах рослин бере участь також в утворенні жирів, у перетворенні фосфорних сполук.
Особливо багато магнію в соку каучуконосних рослин. Брак магнію призводить до зменшення кількості хлорофілу і до побледнению і зміні забарвлення листя на червону і жовту
Англійська сіль (MgSO4 ? 7H2O ) використовується як проносне і жовчогінний засіб. При ін'єкціях вона викликає стан, близький до наркотичного , і використовується для боротьби з судомами, для лікування гіпертонії, психічного збудження ; в поєднанні з іншими препаратами - для знеболювання при пологах.
Водні розчини тіосульфату магнію використовуються для лікування опіків та інших захворювань шкіри.
Біла магнезія ( MgCO3 ) входить до складу зубних порошків і присипок ; крім того, вона зменшує кислотність шлункового соку.
Палена магнезія ( MgO ) теж нейтралізує шлунковий сік . Крім того, вона застосовується всередину при кислотних отруєннях.
Ĉ/ß
Магній входить до складу хлорофілу і, отже, відіграє незамінну роль у фотосинтезі і в газообміні планети; загальний вміст магнію в тканинах рослин на Землі за деякими оцінками складає близько 1011 тонн.
Крім хлорофілу, магній у всіх тканинах рослин бере участь також в утворенні жирів, у перетворенні фосфорних сполук.
Особливо багато магнію в соку каучуконосних рослин. Брак магнію призводить до зменшення кількості хлорофілу і до побледнению і зміні забарвлення листя на червону і жовту
Англійська сіль (MgSO4 ? 7H2O ) використовується як проносне і жовчогінний засіб. При ін'єкціях вона викликає стан, близький до наркотичного , і використовується для боротьби з судомами, для лікування гіпертонії, психічного збудження ; в поєднанні з іншими препаратами - для знеболювання при пологах.
Водні розчини тіосульфату магнію використовуються для лікування опіків та інших захворювань шкіри.
Біла магнезія ( MgCO3 ) входить до складу зубних порошків і присипок ; крім того, вона зменшує кислотність шлункового соку.
Палена магнезія ( MgO ) теж нейтралізує шлунковий сік . Крім того, вона застосовується всередину при кислотних отруєннях.
Ĉ/ß

Слайд #18
Так як у лужному середовищі гинуть мікроорганізми,то речовини з цим середовищем є добрими антисептиками: мило, СМС. Ці речовини,також добре розчиняють жири.
Застосування лужних властивостей сполук металів.
Застосування лужних властивостей сполук металів.

Слайд #19
Користь,та шкода лужного середовища.
Тому, регулярне миття рук з милом ,захистить вас від хвороб
Але в лужному середовищі гинуть як шкідливі,так і корисні мікроорганізми.
Тому, регулярне миття рук з милом ,захистить вас від хвороб
Але в лужному середовищі гинуть як шкідливі,так і корисні мікроорганізми.

Слайд #20
Тож давайте дамо відповідь на наше проблемне питання.

Слайд #21
Перевірка знань
Порівняйте атоми елементів, поставивши знаки <,> або = замість *:
а) заряд ядра: Mg * Ca, Na * Mg, Ca * К;
б) число електронних шарів: Mg * Ca, Na * Mg,
Ca * К;
в) число електронів на зовнішньому рівні: Mg * Ca,
Na * Mg, Ca * К;
г) радіус атома: Mg * Ca, Na * Mg, Ca * K
Порівняйте атоми елементів, поставивши знаки <,> або = замість *:
а) заряд ядра: Mg * Ca, Na * Mg, Ca * К;
б) число електронних шарів: Mg * Ca, Na * Mg,
Ca * К;
в) число електронів на зовнішньому рівні: Mg * Ca,
Na * Mg, Ca * К;
г) радіус атома: Mg * Ca, Na * Mg, Ca * K

Слайд #22
Рефлексія:Продовжіть ланцюжок:
Я знаю …..
Я вмію …..
Я використовую ……
Мені це буде необхідно для …..
Я навчився ……
Я набув вміння …….
Я знаю …..
Я вмію …..
Я використовую ……
Мені це буде необхідно для …..
Я навчився ……
Я набув вміння …….

Слайд #23
Дякую за увагу
