- Головна
- Готові шкільні презентації
- Презентація на тему «Оксиди» (варіант 3)
Презентація на тему «Оксиди» (варіант 3)
388
Слайд #1
План:
Основні відомості
Формули оксидів
Назви оксидів
Класифікація
Фізичні властивості
Хімічні властивості основних оксидів
Хімічні властивості кислотних оксидів
Добування
Використання
Оксиди
Основні відомості
Формули оксидів
Назви оксидів
Класифікація
Фізичні властивості
Хімічні властивості основних оксидів
Хімічні властивості кислотних оксидів
Добування
Використання
Оксиди

Слайд #2
Основні відомості:
Оксиди – це складні речовини, утворені двома елементами, одним з яких обов'язково є Оксиген.
Оксиди – це складні речовини, утворені двома елементами, одним з яких обов'язково є Оксиген.

Слайд #3
Еn Оm
Де Е-елемент,n,m-валентність
Формули оксидів:
Де Е-елемент,n,m-валентність
Формули оксидів:

Слайд #4
Назви оксидів:
Назва елементу
+
Валентність,якщо змінна
+
Слово “оксид”
Назва елементу
+
Валентність,якщо змінна
+
Слово “оксид”

Слайд #5
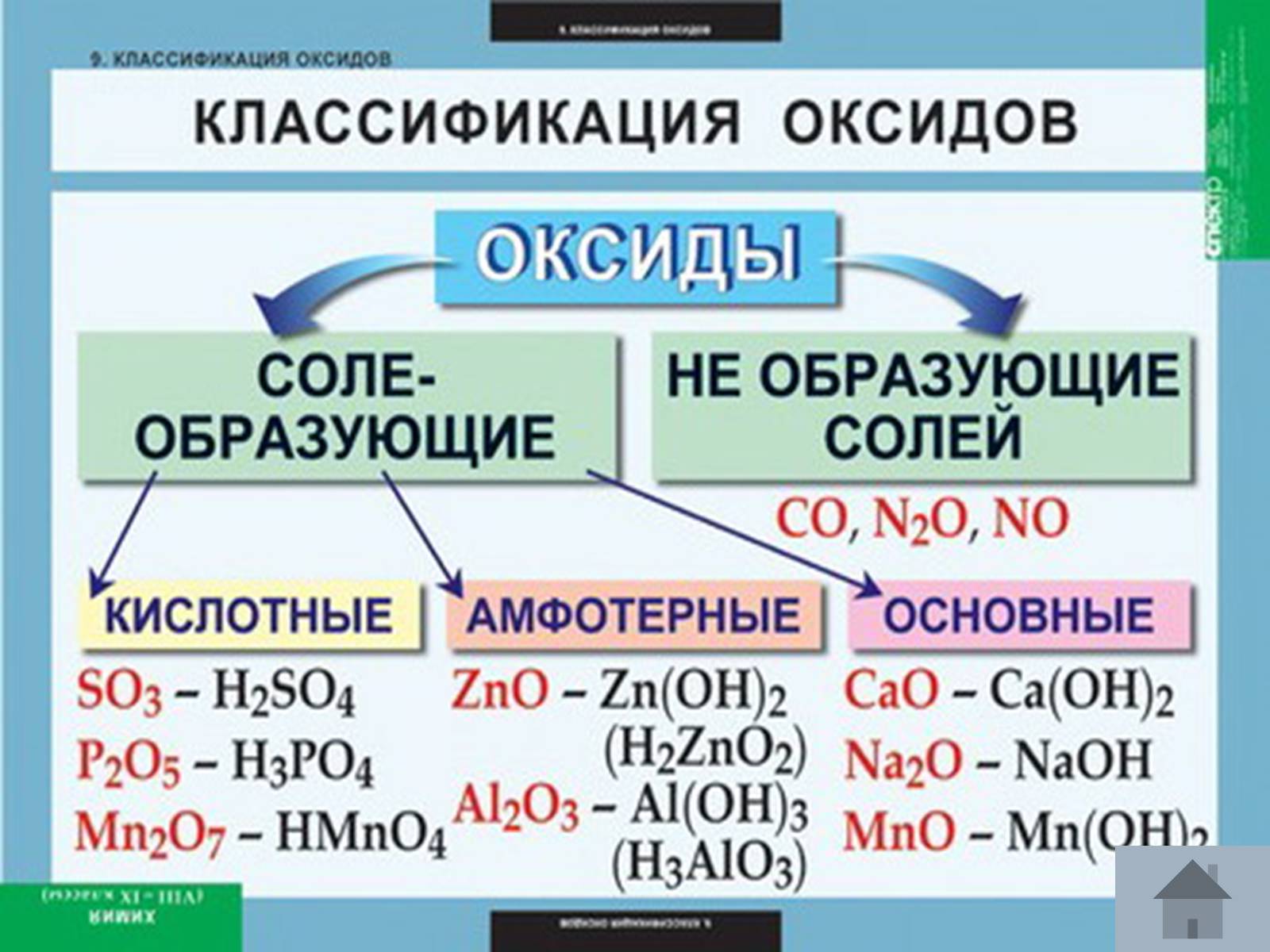
Класифікація:
Са3(РО4)2,ZnSO4,Na2СО3
Класифікація:
Са3(РО4)2,ZnSO4,Na2СО3
Класифікація:
Слайд #6
Виділяють декілька основних фізичних властивостей оксидів:
1) Всі основні й амфотерні оксиди не мають запаху;
2) Оксиди можуть бути різного кольору. Наприклад:a. ZnO, MgO – білий;
b. CuO – чорний;
3) Окремі кислотні оксиди є твердими (P2O5, SiO2 і ін.);
4) Виділяють декілька газоподібних кислотних оксидів (CO2, SO2 і ін.)
Фізичні властивості:
1) Всі основні й амфотерні оксиди не мають запаху;
2) Оксиди можуть бути різного кольору. Наприклад:a. ZnO, MgO – білий;
b. CuO – чорний;
3) Окремі кислотні оксиди є твердими (P2O5, SiO2 і ін.);
4) Виділяють декілька газоподібних кислотних оксидів (CO2, SO2 і ін.)
Фізичні властивості:

Слайд #7
оксид алюмінію
оксид хрому
оксид купруму
оксид цинку
оксид хрому
оксид купруму
оксид цинку

Слайд #8
Хімічні властивості основних оксидів:
1.Взаємодія з водою
Основний оксид+вода=основа
2.Взаємодія з кислотою
Основний оксид+кислота=сіль+вода
3.Взаємодія з кислотним оксидом
Основний оксид+кислотний оксид=сіль
1.Взаємодія з водою
Основний оксид+вода=основа
2.Взаємодія з кислотою
Основний оксид+кислота=сіль+вода
3.Взаємодія з кислотним оксидом
Основний оксид+кислотний оксид=сіль

Слайд #9
Хімічні властивості кислотних оксидів:
1.Взаємодія з водою
Кислотний оксид+вода=кислота
2.Взаємодія з основами
Кислотний оксид+основа=сіль+вода
3.Взаємодія з основним оксидом
Основний оксид+кислотний оксид=сіль
1.Взаємодія з водою
Кислотний оксид+вода=кислота
2.Взаємодія з основами
Кислотний оксид+основа=сіль+вода
3.Взаємодія з основним оксидом
Основний оксид+кислотний оксид=сіль

Слайд #10
Добування:
Оксиди можна одержувати різними способами.
Безпосереднім сполученням елементів з киснем:
2 Zn + O2 = 2ZnO
4Р + 5О2 = 2Р2О5
Окисленням різних сполук киснем:
СН4 + 2О2 = СО2 + 2Н2О
2Н2S + 3О2 = 2SO2 + 2Н2О
Розкладом гідроксидів при нагріванні:
Ca(ОН)2 = СаО + Н2О
2Fe(ОН)3 = Fe2О3 + 3Н2О
Розкладом солей кисневих кислот при нагріванні:
CaCO3 = CaO + СО2
Cu2(ОН)2СО3 = CuO + СО2 + Н2О
Оксиди можна одержувати різними способами.
Безпосереднім сполученням елементів з киснем:
2 Zn + O2 = 2ZnO
4Р + 5О2 = 2Р2О5
Окисленням різних сполук киснем:
СН4 + 2О2 = СО2 + 2Н2О
2Н2S + 3О2 = 2SO2 + 2Н2О
Розкладом гідроксидів при нагріванні:
Ca(ОН)2 = СаО + Н2О
2Fe(ОН)3 = Fe2О3 + 3Н2О
Розкладом солей кисневих кислот при нагріванні:
CaCO3 = CaO + СО2
Cu2(ОН)2СО3 = CuO + СО2 + Н2О

Слайд #11
Використання:
Оксиди багатьох елементів дуже поширені в природі. Як ти гадаєш, чому?
Наприклад, така добре відома сполука, як звичайний річковий пісок (з деякими домішками) є оксидом з формулою SiO2 – силіцій(IV) оксид (кремнезем).
Майже чистим кремнеземом є гірський кришталь.
Цей оксид разом з алюміній оксидом Al2O3 входить до складу глин та багатьох інших мінералів.
З руд, які містять алюміній оксид Al2O3, виплавляють алюміній.
Звичайний наждак – це також алюміній оксид з домішками.
Алюміній оксид з невеликим вмістом різних домішок може бути і коштовним каменем (рубін, сапфір).
Дуже поширені в природі й оксиди Феруму – це різні залізні руди. Україна має великі запаси залізних руд (Криворізьке та Керченське родовища).
До складу повітря входить карбон(IV) оксид СО2 (вуглекислий газ), об'ємна частка якого в повітрі становить 0,3 %.
Однак найпоширенішим оксидом у природі є гідроген оксид Н2О (вода).
Оксиди багатьох елементів дуже поширені в природі. Як ти гадаєш, чому?
Наприклад, така добре відома сполука, як звичайний річковий пісок (з деякими домішками) є оксидом з формулою SiO2 – силіцій(IV) оксид (кремнезем).
Майже чистим кремнеземом є гірський кришталь.
Цей оксид разом з алюміній оксидом Al2O3 входить до складу глин та багатьох інших мінералів.
З руд, які містять алюміній оксид Al2O3, виплавляють алюміній.
Звичайний наждак – це також алюміній оксид з домішками.
Алюміній оксид з невеликим вмістом різних домішок може бути і коштовним каменем (рубін, сапфір).
Дуже поширені в природі й оксиди Феруму – це різні залізні руди. Україна має великі запаси залізних руд (Криворізьке та Керченське родовища).
До складу повітря входить карбон(IV) оксид СО2 (вуглекислий газ), об'ємна частка якого в повітрі становить 0,3 %.
Однак найпоширенішим оксидом у природі є гідроген оксид Н2О (вода).

Слайд #12
Для отримання скла складають шихту-суміш соди Na2CO3 (іноді сульфату натрію з вугіллям), вапняку CaCO3, кварцового піску, що містить 97-99,8% SiO2, і різних добавок. шихту поміщають в спеціальні печі і сплавляють, поступово підвищуючи температуру до 1460-1500 градусів.

Слайд #13
Вода – це найдивовижніша, найпоширеніша і найнеобхідніша речовина на нашій планеті.
Багато води перебуває у газуватому стані в атмосфері. У вигляді великих мас снігу і криги лежить вода цілорічно на вершинах високих гір і в полярних країнах. У надрах Землі також є вода, що просочує грунт і гірські породи. Воді належить найважливіша роль у геологічній історії нашої планети.
Вода має велике значення у промисловості, вона незамінний компонент практично всіх технологічних процесів. На виробництво 1 т сталі, наприклад, витрачається 300 м3 води, 1 т паперу – 900 м3, 1 т хімічного волокна – понад 2000 м3.
У всякому організмі вода є середовищем, в якому відбуваються хімічні процеси, що забезпечують життєдіяльність організму, і сама вода бере участь у багатьох біохімічних реакціях. Відомо, що масова частка води в організмі людини становить 65 %.
Багато води перебуває у газуватому стані в атмосфері. У вигляді великих мас снігу і криги лежить вода цілорічно на вершинах високих гір і в полярних країнах. У надрах Землі також є вода, що просочує грунт і гірські породи. Воді належить найважливіша роль у геологічній історії нашої планети.
Вода має велике значення у промисловості, вона незамінний компонент практично всіх технологічних процесів. На виробництво 1 т сталі, наприклад, витрачається 300 м3 води, 1 т паперу – 900 м3, 1 т хімічного волокна – понад 2000 м3.
У всякому організмі вода є середовищем, в якому відбуваються хімічні процеси, що забезпечують життєдіяльність організму, і сама вода бере участь у багатьох біохімічних реакціях. Відомо, що масова частка води в організмі людини становить 65 %.
