- Головна
- Готові шкільні презентації
- Презентація на тему «Розчинник»
Презентація на тему «Розчинник»
710
Слайд #1
“РОЗЧИННИК”

Слайд #2
Розчини - однорідна багатокомпонентна система, що складається з розчинника, розчинених речовин і продуктів їх взаємодії.
Розчини - це молекулярні суміші, які за агрегатним станом можуть бути рідкими - морська вода, газоподібними – повітря ,або твердими - багато сплавів металів.
Розчини - це молекулярні суміші, які за агрегатним станом можуть бути рідкими - морська вода, газоподібними – повітря ,або твердими - багато сплавів металів.

Слайд #3
Розчини - однорідна багатокомпонентна система, що складається з розчинника, розчинених речовин і продуктів їх взаємодії.
Розчини - це молекулярні суміші, які за агрегатним станом можуть бути рідкими - морська вода, газоподібними – повітря ,або твердими - багато сплавів металів.
Розчини - це молекулярні суміші, які за агрегатним станом можуть бути рідкими - морська вода, газоподібними – повітря ,або твердими - багато сплавів металів.

Слайд #4
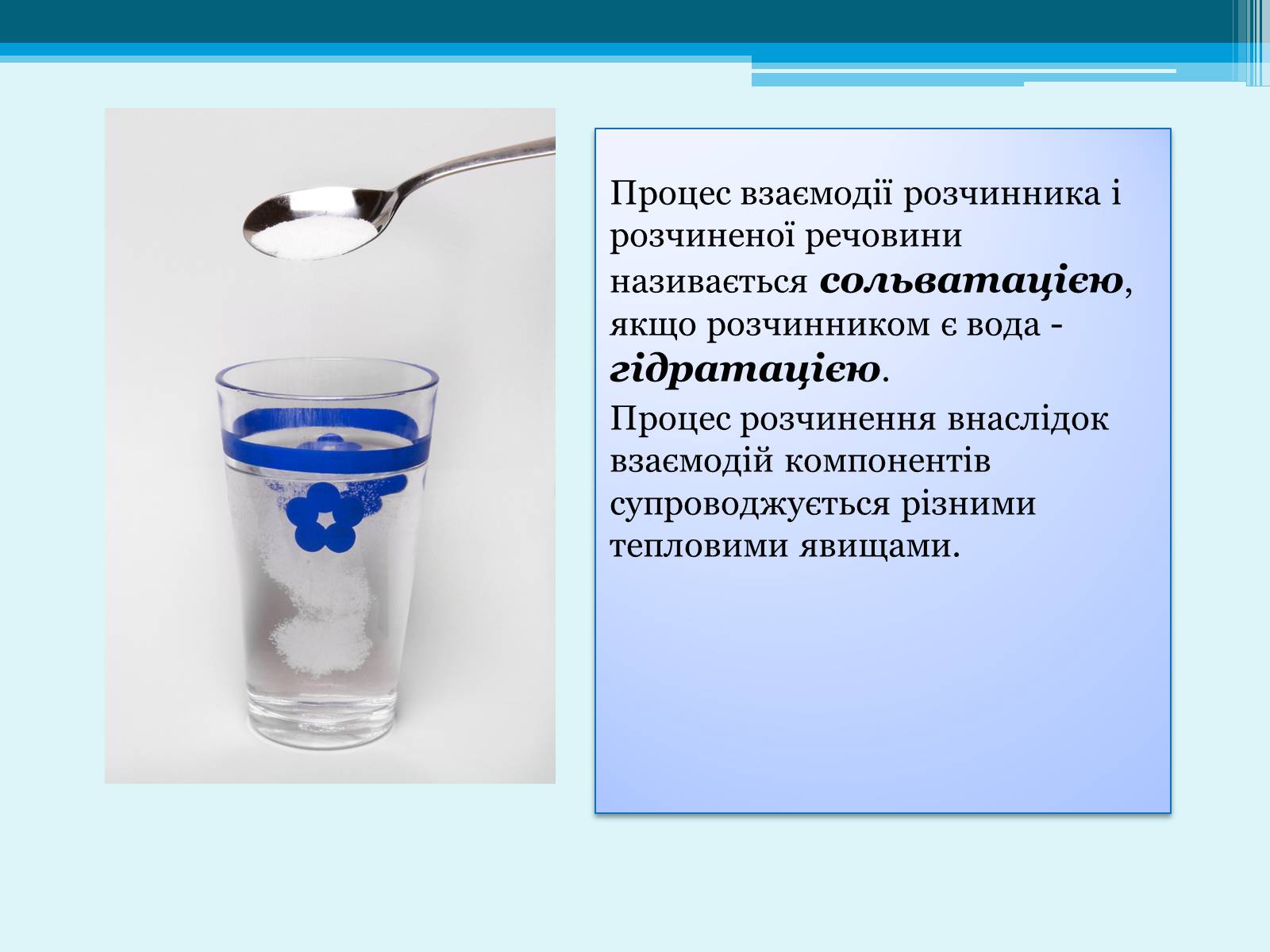
Процес взаємодії розчинника і розчиненої речовини називається сольватацією, якщо розчинником є вода - гідратацією.
Процес розчинення внаслідок взаємодій компонентів супроводжується різними тепловими явищами.
Процес розчинення внаслідок взаємодій компонентів супроводжується різними тепловими явищами.
Слайд #5
Процес взаємодії розчинника і розчиненої речовини називається сольватацією, якщо розчинником є вода - гідратацією.
Процес розчинення внаслідок взаємодій компонентів супроводжується різними тепловими явищами.
Процес розчинення внаслідок взаємодій компонентів супроводжується різними тепловими явищами.

Слайд #6
Розчинністю - називається здатність речовини розчинятися в тому чи іншому розчиннику.
Розчинність залежить від природи речовини і розчинника,температури і тиску.
Розчинність залежить від природи речовини і розчинника,температури і тиску.

Слайд #7
Розчинністю - називається здатність речовини розчинятися в тому чи іншому розчиннику.
Розчинність залежить від природи речовини і розчинника,температури і тиску.
Розчинність залежить від природи речовини і розчинника,температури і тиску.

Слайд #8
Чинники, що впливають на розчинність

Слайд #9
Концентрація розчинів
Масова частка розчиненої речовини - це безрозмірна величина,що дорівнює відношенню маси розчиненої речовини до загальної маси розчину.
Молярна концентрація показує, скільки моль розчиненої речовини міститься в 1 літрі розчину.
Масова частка розчиненої речовини - це безрозмірна величина,що дорівнює відношенню маси розчиненої речовини до загальної маси розчину.
Молярна концентрація показує, скільки моль розчиненої речовини міститься в 1 літрі розчину.

Слайд #10
Дисперсні системи – це системи, в яких одна речовина рівномірно розподілено у вигляді частинок всередині іншої речовини.
До дисперсних систем відносяться звичайні (справжні) розчини, колоїдні розчини, а також суспензії та емульсії.
До дисперсних систем відносяться звичайні (справжні) розчини, колоїдні розчини, а також суспензії та емульсії.

Слайд #11
Суспензії - це дисперсні системи, в яких дисперсної фазою є тверда речовина, а дисперсним середовищем – рідина.

Слайд #12
Емульсії - це дисперсні системи, в яких і дисперсна фаза і дисперсне середовище є рідинами, взаємно не змішуються. Прикладом емульсії є молоко, в якому дрібні кульки жиру плавають у рідині.

Слайд #13
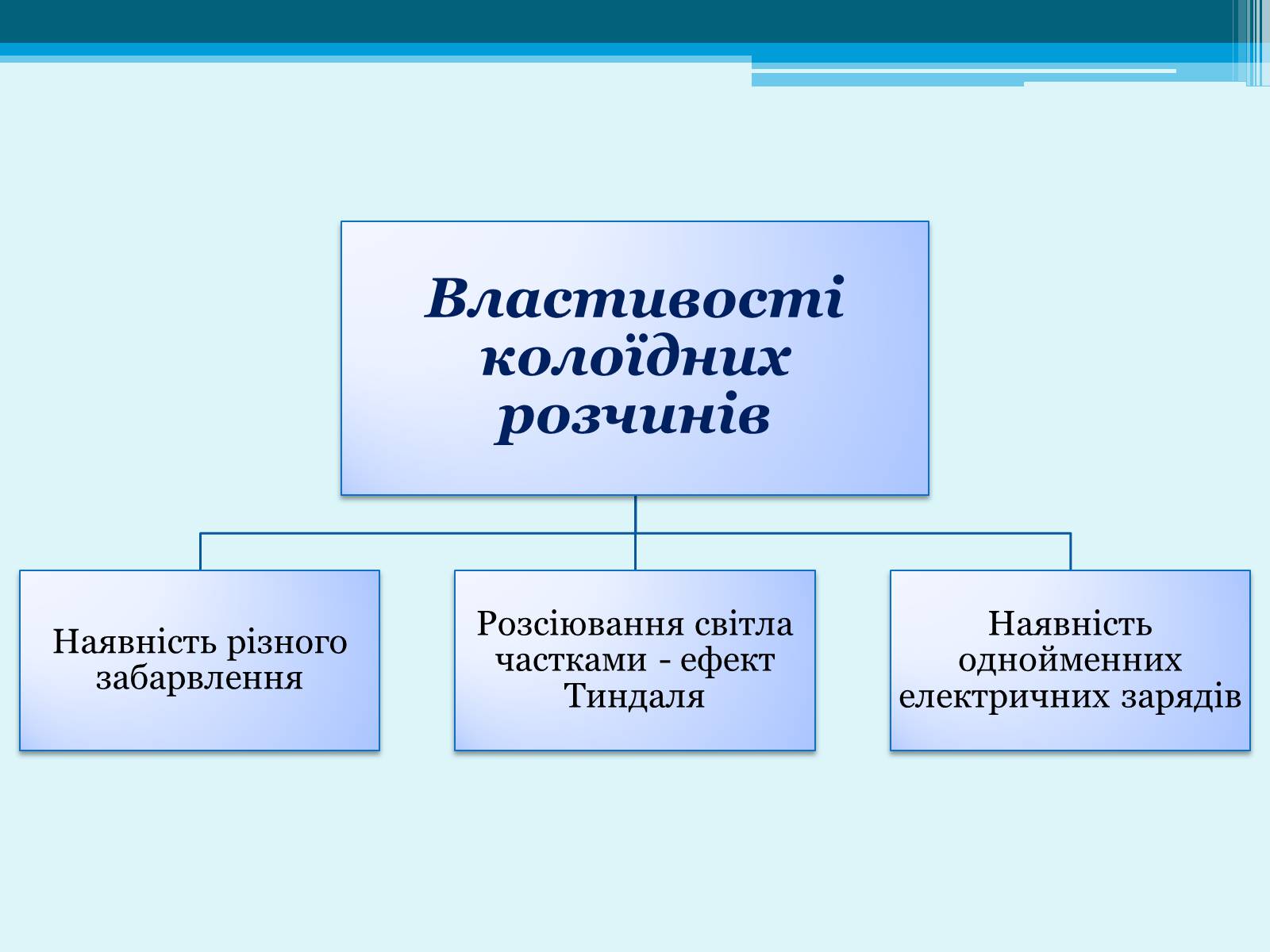
Колоїдні розчини - це високодисперсні двофазні системи, що складаються з дисперсійного середовища і дисперсної фази, причому лінійні розміри частинок останньої лежать в межах від 1 до 100 нм.
Колоїдні розчини інакше називають золями.
Колоїдні розчини інакше називають золями.

Слайд #14
Колоїдні розчини - це високодисперсні двофазні системи, що складаються з дисперсійного середовища і дисперсної фази, причому лінійні розміри частинок останньої лежать в межах від 1 до 100 нм.
Колоїдні розчини інакше називають золями.
Колоїдні розчини інакше називають золями.
Слайд #15
Для осадження золю необхідно, щоб його частинки з'єдналися в більш великі агрегати. З'єднання часток в більш великі агрегати називається коагуляцією, а осадження їх під впливом сили тяжіння - седиментацією.
Значення золів виключно велике, тому що вони більш поширені, ніж істинні розчини: протоплазма живих клітин, кров, соки рослин.
Значення золів виключно велике, тому що вони більш поширені, ніж істинні розчини: протоплазма живих клітин, кров, соки рослин.

Слайд #16
Колігативні властивості— властивості розчинів, які залежать від кількості частинок розчинених речовин і не залежать від їх природи.

Слайд #17
Зниження тиску насиченої пари розчину описується законом Рауля: відносне зниження тиску насиченої пари розчинника над розчином рівне мольній частці розчиненої речовини.

Слайд #18
Щоб кількісно оцінити збільшення температури кипіння і зменшення температури плавлення розчину, слід знайти температуру при якій, за сталого тиску (1 атм.), пара чистого розчинника або чистий розчинник у твердій формі відповідно має такий же хімічний потенціал, як і розчинник у розчині.

Слайд #19
Осмос— це спонтанний перехід чистого розчинника у розчин, відділений від нього напівпроникною мембраною. Значення осмотичного тиску для сильно розведених розчинів можна приблизно обчислити, використовуючи рівняння, виведене Вант-Гоффом.

Слайд #20
Причини застосування розчинів

Слайд #21
Дякуємо за увагу!
