- Головна
- Готові шкільні презентації
- Презентація на тему «Нітратна кислота» (варіант 1)
Презентація на тему «Нітратна кислота» (варіант 1)
1032
Слайд #1
Підготував:
Учень 10-А класу
Луцької ЗОШ № 25
Матвійчук Роман
Презентація на тему: “Нітратна кислота”
Учень 10-А класу
Луцької ЗОШ № 25
Матвійчук Роман
Презентація на тему: “Нітратна кислота”

Слайд #2
Зміст
1) HNO3 — загальні знання.
2) Трішки історії.
3) Промислове виробництво.
4) Фізичні властивості.
5) Хімічні властивості.
6) Застосування.
7) Нітрати.
8) Негативний вплив нітратів.
9) Заключення.
1) HNO3 — загальні знання.
2) Трішки історії.
3) Промислове виробництво.
4) Фізичні властивості.
5) Хімічні властивості.
6) Застосування.
7) Нітрати.
8) Негативний вплив нітратів.
9) Заключення.

Слайд #3
HNO3 — загальні знання
Нітратна кислота (HNO3) — сильна одноосновна кислота. Висококорозійна кислота, реагує з більшістю металів, сильний окисник. Має тенденцію набувати жовтого відтінку через накопичення оксидів азоту, при довгому зберіганні. Зазвичай азотна кислота має концентрацію 68%. Якщо ж більше 86%, то вона називається димною кислотою. В залежності від кольору "диму" концентрована кислота поділяється на білу та червону в концентраціїї більшій за 95 %.
Нітратна кислота (HNO3) — сильна одноосновна кислота. Висококорозійна кислота, реагує з більшістю металів, сильний окисник. Має тенденцію набувати жовтого відтінку через накопичення оксидів азоту, при довгому зберіганні. Зазвичай азотна кислота має концентрацію 68%. Якщо ж більше 86%, то вона називається димною кислотою. В залежності від кольору "диму" концентрована кислота поділяється на білу та червону в концентраціїї більшій за 95 %.

Слайд #4
Трішки історії
Р. Дж. Глаубер отримав в середині 17-го сторіччя, чисту нітратну кислоту реакцією і перегонкою селітри з сірчаною кислотою, зараз цей процес застосовується при лабораторному отриманні кислоти.
Склад кислоти вперше визначив А.Лавуазьє в 18 сторіччі, він визначив що речовина має в своєму складі азот та кисень та точна формула не була відома. Точний склад був визначений Генрі Кавендішем. Промислове виробництво почалося лише на початку 19 століття, коли сірчана кислота та нітрат натрію були доступні в великих кількостях.
Р. Дж. Глаубер отримав в середині 17-го сторіччя, чисту нітратну кислоту реакцією і перегонкою селітри з сірчаною кислотою, зараз цей процес застосовується при лабораторному отриманні кислоти.
Склад кислоти вперше визначив А.Лавуазьє в 18 сторіччі, він визначив що речовина має в своєму складі азот та кисень та точна формула не була відома. Точний склад був визначений Генрі Кавендішем. Промислове виробництво почалося лише на початку 19 століття, коли сірчана кислота та нітрат натрію були доступні в великих кількостях.

Слайд #5
Промислове виробництво
Азотну кислоту отримують шляхом реакції діоксиду азоту (NO2) з водою.
3NO2 + H2 → 2HNO3 + NO як правило, монооксид азоту який утворюється в результаті реакціїї, знову окислюється киснем повітря та може бути використаний для отримання додаткового діоксиду азоту. Майже чиста азотна кислота може бути отримана шляхом реакції сірчаної кислоти з натрієвою селітрою.
Азотну кислоту отримують шляхом реакції діоксиду азоту (NO2) з водою.
3NO2 + H2 → 2HNO3 + NO як правило, монооксид азоту який утворюється в результаті реакціїї, знову окислюється киснем повітря та може бути використаний для отримання додаткового діоксиду азоту. Майже чиста азотна кислота може бути отримана шляхом реакції сірчаної кислоти з натрієвою селітрою.

Слайд #6
Фізичні властивості
Нітратна кислота є безбарвною димучою рідиною з їдким запахом, легко розкладається, забарвлюючись у жовтий колір. Густина 1,53 г/см³. Кипить при 86°С, замерзає при — 41°С. На повітрі HNO3 «димить» внаслідок притягання її парами вологого повітря і утворення дрібненьких крапельок туману.
Нітратна кислота нестійка і вже під впливом сонячного світла поступово розкладається: 4HNO3 = 4NO2 + O2 + 2H2O
При нагріванні розклад її значно прискорюється. Утворюваний діоксид азоту розчиняється в HNO3 і надає їй жовтуватого кольору. У водних розчинах нітратна кислота значно стійкіша. З водою HNO3 змішується в будь-яких співвідношеннях.
Нітратна кислота належить до сильних кислот, у водних розчинах вона практично повністю дисоціює.
Нітратна кислота є безбарвною димучою рідиною з їдким запахом, легко розкладається, забарвлюючись у жовтий колір. Густина 1,53 г/см³. Кипить при 86°С, замерзає при — 41°С. На повітрі HNO3 «димить» внаслідок притягання її парами вологого повітря і утворення дрібненьких крапельок туману.
Нітратна кислота нестійка і вже під впливом сонячного світла поступово розкладається: 4HNO3 = 4NO2 + O2 + 2H2O
При нагріванні розклад її значно прискорюється. Утворюваний діоксид азоту розчиняється в HNO3 і надає їй жовтуватого кольору. У водних розчинах нітратна кислота значно стійкіша. З водою HNO3 змішується в будь-яких співвідношеннях.
Нітратна кислота належить до сильних кислот, у водних розчинах вона практично повністю дисоціює.

Слайд #7
Хімічні властивості

Слайд #8
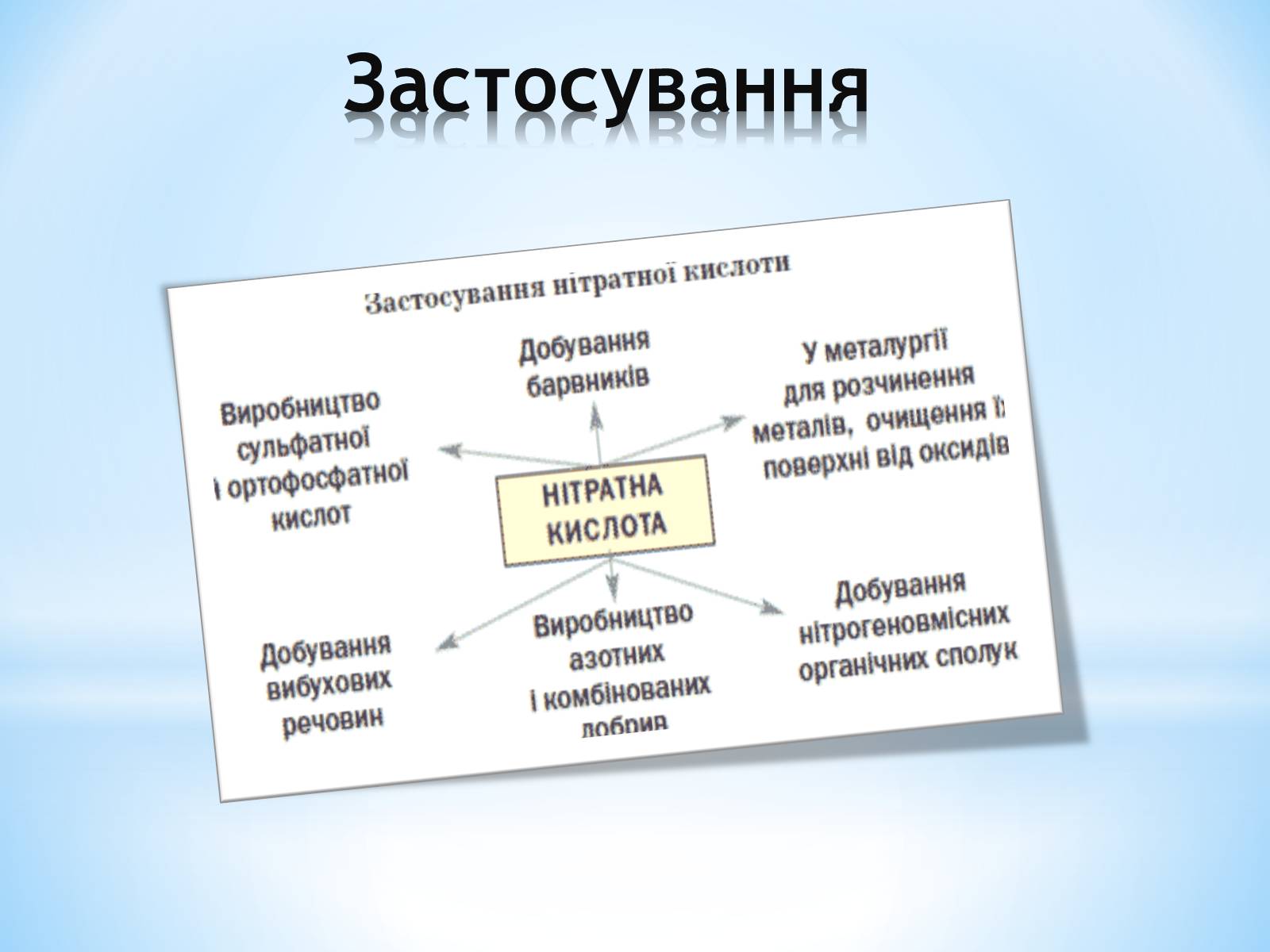
Застосування
Слайд #9
Нітрати
Одноосновна нітратна кислота утворює лише середні солі – нітрати. Нітрати добре розчинні у воді, токсичні, тверді кристалічні речовини. Нітрати натрію, калію, кальцію та амонію називають селітрами або нітратними добривами.
Нітрати, як і нітратна кислота, здатні розкладатися під час нагрівання. Нітрати застосовують у виробництві ковбас, шинки, риби, деяких сортів сиру. Перетворюючись на натрій нітрит під дією мікроорганізмів, він перешкоджає окисненню м'яса і зберігає привабливий рожевий колір м'ясних виробів, поліпшує смак сирів, облагороджує їх запах.
Гранична допустима доза споживання нітратів на добу складає 5мг/кг маси тіла. Перевищення норм призводить до порушення функцій крові, створюючи загрозу для життя.
Одноосновна нітратна кислота утворює лише середні солі – нітрати. Нітрати добре розчинні у воді, токсичні, тверді кристалічні речовини. Нітрати натрію, калію, кальцію та амонію називають селітрами або нітратними добривами.
Нітрати, як і нітратна кислота, здатні розкладатися під час нагрівання. Нітрати застосовують у виробництві ковбас, шинки, риби, деяких сортів сиру. Перетворюючись на натрій нітрит під дією мікроорганізмів, він перешкоджає окисненню м'яса і зберігає привабливий рожевий колір м'ясних виробів, поліпшує смак сирів, облагороджує їх запах.
Гранична допустима доза споживання нітратів на добу складає 5мг/кг маси тіла. Перевищення норм призводить до порушення функцій крові, створюючи загрозу для життя.

Слайд #10
Негативний вплив нітратів
Нітрати характеризуються досить широким спектром токсичної дії. Токсична дія нітратів полягає у тому, що в травному тракті вони частково відновлюються до нітритів (більш токсичних), і останні при надходженні в кров можуть викликати метгемоглобінемію, а також пригнічення активності ферментних систем, що беруть участь у процесах тканинного дихання.
Крім того, встановлено, що з нітритів у присутності амінів можуть утворюватись N-нітрозаміни, які виявляють канцерогенну активність. При вживанні високих доз нітратів з питною водою, чи продуктами харчування через 4-6 годин проявляються характерні симптоми нітратного отруєння: нудота, задуха, посиніння шкірних покривів і слизових оболонок, діарея. Це часто супроводжується загальною слабкістю, головокружінням, запамороченням, болями у потиличній частині, тахікардією.
Нітрати характеризуються досить широким спектром токсичної дії. Токсична дія нітратів полягає у тому, що в травному тракті вони частково відновлюються до нітритів (більш токсичних), і останні при надходженні в кров можуть викликати метгемоглобінемію, а також пригнічення активності ферментних систем, що беруть участь у процесах тканинного дихання.
Крім того, встановлено, що з нітритів у присутності амінів можуть утворюватись N-нітрозаміни, які виявляють канцерогенну активність. При вживанні високих доз нітратів з питною водою, чи продуктами харчування через 4-6 годин проявляються характерні симптоми нітратного отруєння: нудота, задуха, посиніння шкірних покривів і слизових оболонок, діарея. Це часто супроводжується загальною слабкістю, головокружінням, запамороченням, болями у потиличній частині, тахікардією.

Слайд #11
Заключення
Нітратна кислота (HNO3) — сильна одноосновна кислота. Висококорозійна кислота, реагує з більшістю металів, сильний окисник + нітратна кислота є одним з найважливіших продуктів хімічної промисловості.
Нітратна кислота (HNO3) — сильна одноосновна кислота. Висококорозійна кислота, реагує з більшістю металів, сильний окисник + нітратна кислота є одним з найважливіших продуктів хімічної промисловості.

Слайд #12
