- Головна
- Готові шкільні презентації
- Презентація на тему «Спирти» (варіант 1)
Презентація на тему «Спирти» (варіант 1)
425
Слайд #1
Спирти

Слайд #2
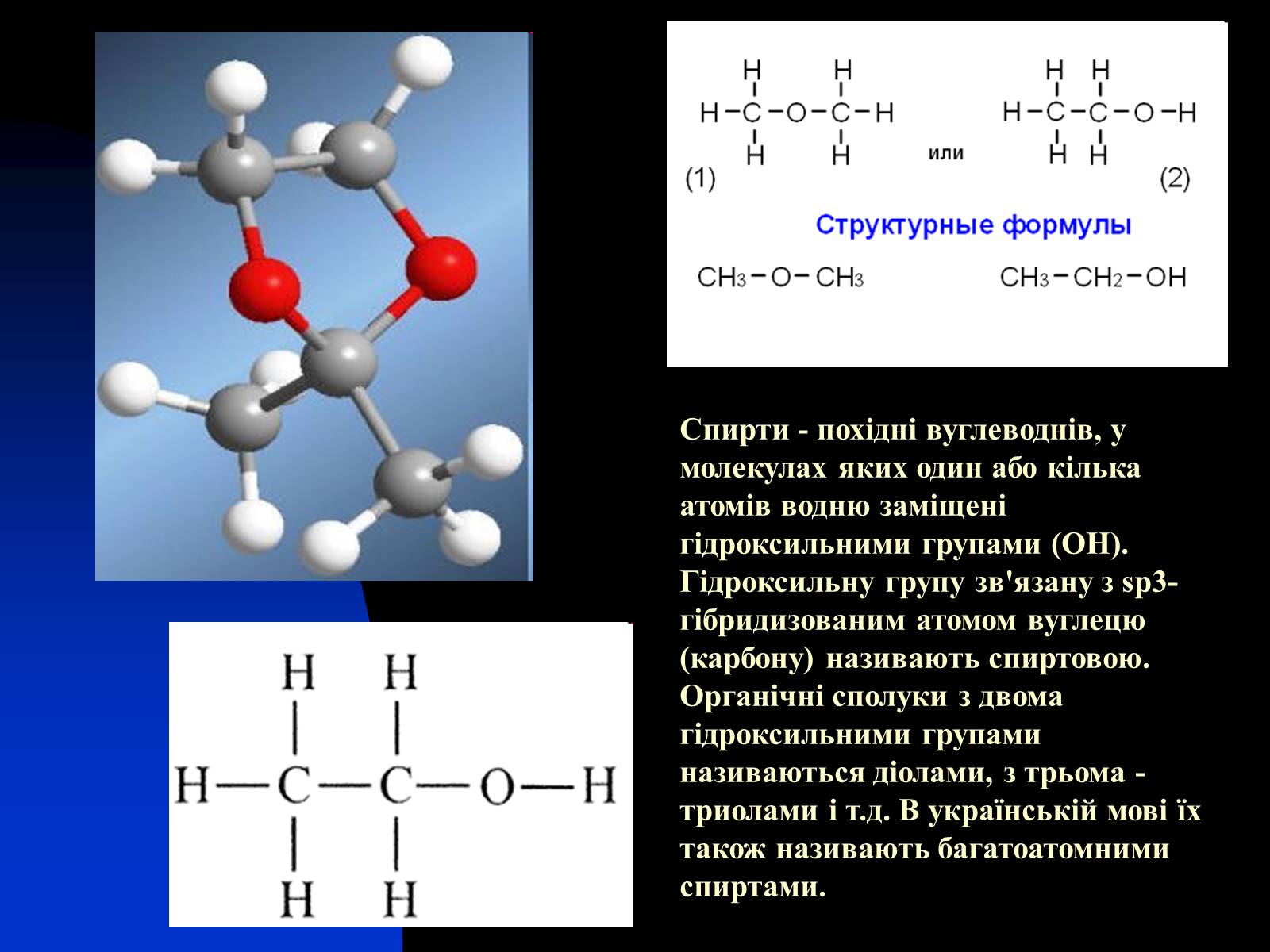
Спирти - похідні вуглеводнів, у молекулах яких один або кілька атомів водню заміщені гідроксильними групами (OH). Гідроксильну групу зв'язану з sp3-гібридизованим атомом вуглецю (карбону) називають спиртовою. Органічні сполуки з двома гідроксильними групами називаються діолами, з трьома - триолами і т.д. В українській мові їх також називають багатоатомними спиртами.
Слайд #3
Етиловий спирт, вірніше рослинний хмільний напій, що його містить, був відомий людству з глибокої давнини. Вважається, що не менш ніж за 8000 років до нашої ери люди виготовляли легкі спиртні напої з фруктів і меду.
Вперше спирт з вина отримали в 6-7 століттях арабські хіміки, а першу пляшку міцного алкоголю (прообразу сучасної горілки) виготовив перський алхімік Ар-Рази в 860 році.
Історія спирту
У Європі етиловий спирт був отриманий із продуктів бродіння в 11-12 столітті, в Італії.
До Росії спирт вперше потрапив у 1386 році, коли генуезьке посольство привезло його з собою під назвою «аква віта» і презентувала царського двору.
У 1660 році англійський хімік і богослов Роберт Бойль вперше отримав зневоднений етиловий спирт, а також відкрив його деякі фізичні і хімічні властивості, зокрема виявивши здатність етанолу бути високотемпературним пальним для пальників. Абсолютний (безводний) етиловий спирт був отриманий у 1796 році російським хіміком Т.Є. Ловіцем.
Вперше спирт з вина отримали в 6-7 століттях арабські хіміки, а першу пляшку міцного алкоголю (прообразу сучасної горілки) виготовив перський алхімік Ар-Рази в 860 році.
Історія спирту
У Європі етиловий спирт був отриманий із продуктів бродіння в 11-12 столітті, в Італії.
До Росії спирт вперше потрапив у 1386 році, коли генуезьке посольство привезло його з собою під назвою «аква віта» і презентувала царського двору.
У 1660 році англійський хімік і богослов Роберт Бойль вперше отримав зневоднений етиловий спирт, а також відкрив його деякі фізичні і хімічні властивості, зокрема виявивши здатність етанолу бути високотемпературним пальним для пальників. Абсолютний (безводний) етиловий спирт був отриманий у 1796 році російським хіміком Т.Є. Ловіцем.

Слайд #4
Класифікація спиртів
Якщо до складу молекули спирту входить одна гідроксильна група, то такий спирт називають одноатомним, коли дві — двоатомним і т. д. Спирти, молекули яких містять дві і більше гідроксильних груп, називають багатоатомними. Якщо спирт походить від насиченого вуглеводню, то його називають насиченим, а коли від ненасиченого, то ненасиченим. В залежності від типу атома, до якого приєднана гідроксильна група спирти поділяють на первинні, вторинні та третинні.
Спирти, як і вуглеводні, утворюють гомологічні ряди. Кожний наступний член цього ряду відрізняється від попереднього на гомологічну різницю CH2.
Якщо до складу молекули спирту входить одна гідроксильна група, то такий спирт називають одноатомним, коли дві — двоатомним і т. д. Спирти, молекули яких містять дві і більше гідроксильних груп, називають багатоатомними. Якщо спирт походить від насиченого вуглеводню, то його називають насиченим, а коли від ненасиченого, то ненасиченим. В залежності від типу атома, до якого приєднана гідроксильна група спирти поділяють на первинні, вторинні та третинні.
Спирти, як і вуглеводні, утворюють гомологічні ряди. Кожний наступний член цього ряду відрізняється від попереднього на гомологічну різницю CH2.

Слайд #5
Класифікація спиртів
Назви спиртів походять від назв вуглеводневих радикалів, що входять до складу молекули спиртів. Міжнародні їх назви утворюються з назв відповідних вуглеводів з додаванням закінчення ол. Наприклад, CH3—OH — метиловий спирт, або метанол; C2H5—OH — етиловий спирт, або етанол і т. д.
Загальна формула одноатомних насичених спиртів CnH2n+1OH або R—OH, де R — вуглеводневий радикал.
Назви спиртів походять від назв вуглеводневих радикалів, що входять до складу молекули спиртів. Міжнародні їх назви утворюються з назв відповідних вуглеводів з додаванням закінчення ол. Наприклад, CH3—OH — метиловий спирт, або метанол; C2H5—OH — етиловий спирт, або етанол і т. д.
Загальна формула одноатомних насичених спиртів CnH2n+1OH або R—OH, де R — вуглеводневий радикал.

Слайд #6
Метанол
інші назви: метиловий спирт, карбінол, деревний спирт; формула: CH3OH — найпростіший одноатомний спирт, безбарвна рідина зі слабим спиртовим запахом.
Історія отримання
Вперше метанол був виявлений ще в середині XVII століття Робертом Бойлем при вивченні продуктів перегонки дерева, проте в чистому вигляді метиловий спирт, або деревний отриманий цим способом, був виділений тільки через 200 років: тоді вперше вдалося очистити його від домішок супутніх речовин, перш за все оцтової кислоти і ацетону. У 1857 році Марселен Бертло отримав метанол омиленням хлористого метилу.
Сучасний метод отримання — каталітичний синтез з оксиду карбону (II) і гідрогену (температура 250ºС, тиск 7Мпа, каталізатор суміш оксиду цинку і купруму (II)):
СО + 2Н2 → CH3OH
інші назви: метиловий спирт, карбінол, деревний спирт; формула: CH3OH — найпростіший одноатомний спирт, безбарвна рідина зі слабим спиртовим запахом.
Історія отримання
Вперше метанол був виявлений ще в середині XVII століття Робертом Бойлем при вивченні продуктів перегонки дерева, проте в чистому вигляді метиловий спирт, або деревний отриманий цим способом, був виділений тільки через 200 років: тоді вперше вдалося очистити його від домішок супутніх речовин, перш за все оцтової кислоти і ацетону. У 1857 році Марселен Бертло отримав метанол омиленням хлористого метилу.
Сучасний метод отримання — каталітичний синтез з оксиду карбону (II) і гідрогену (температура 250ºС, тиск 7Мпа, каталізатор суміш оксиду цинку і купруму (II)):
СО + 2Н2 → CH3OH

Слайд #7
Етанол
— це сильна психоактивна речовина і один з найстаріших наркотиків, протоплазматична отрута; головна діюча складова алкогольних напоїв. Можливе отримання вільного етанолу дистиляцією вперше було задокументовано арабськими алхіміками приблизно у 10-му сторіччі.
Залежно від вмісту води, способу отримання та мети використання існує багато різних етаноловмісних продуктів. Найбільшого широкого вжитку набула суміш 95,6 мас% етанолу та 4,4 мас% води, такий вміст етилового спирту максимально можливий за звичайної фракційної перегонки, бо це співвідношення утворює азеотропну суміш з температурою кипіння 78,15 °C.
Крім харчових продуктів етиловий спирт у великій кількості споживається як пальне, розчинник та як сировина в різноманітних промислових процесах. Для промислових потреб етиловий спирт часто виробляють з нафтової та газової сировини каталітичною гідратацією етилену.
— це сильна психоактивна речовина і один з найстаріших наркотиків, протоплазматична отрута; головна діюча складова алкогольних напоїв. Можливе отримання вільного етанолу дистиляцією вперше було задокументовано арабськими алхіміками приблизно у 10-му сторіччі.
Залежно від вмісту води, способу отримання та мети використання існує багато різних етаноловмісних продуктів. Найбільшого широкого вжитку набула суміш 95,6 мас% етанолу та 4,4 мас% води, такий вміст етилового спирту максимально можливий за звичайної фракційної перегонки, бо це співвідношення утворює азеотропну суміш з температурою кипіння 78,15 °C.
Крім харчових продуктів етиловий спирт у великій кількості споживається як пальне, розчинник та як сировина в різноманітних промислових процесах. Для промислових потреб етиловий спирт часто виробляють з нафтової та газової сировини каталітичною гідратацією етилену.

Слайд #8
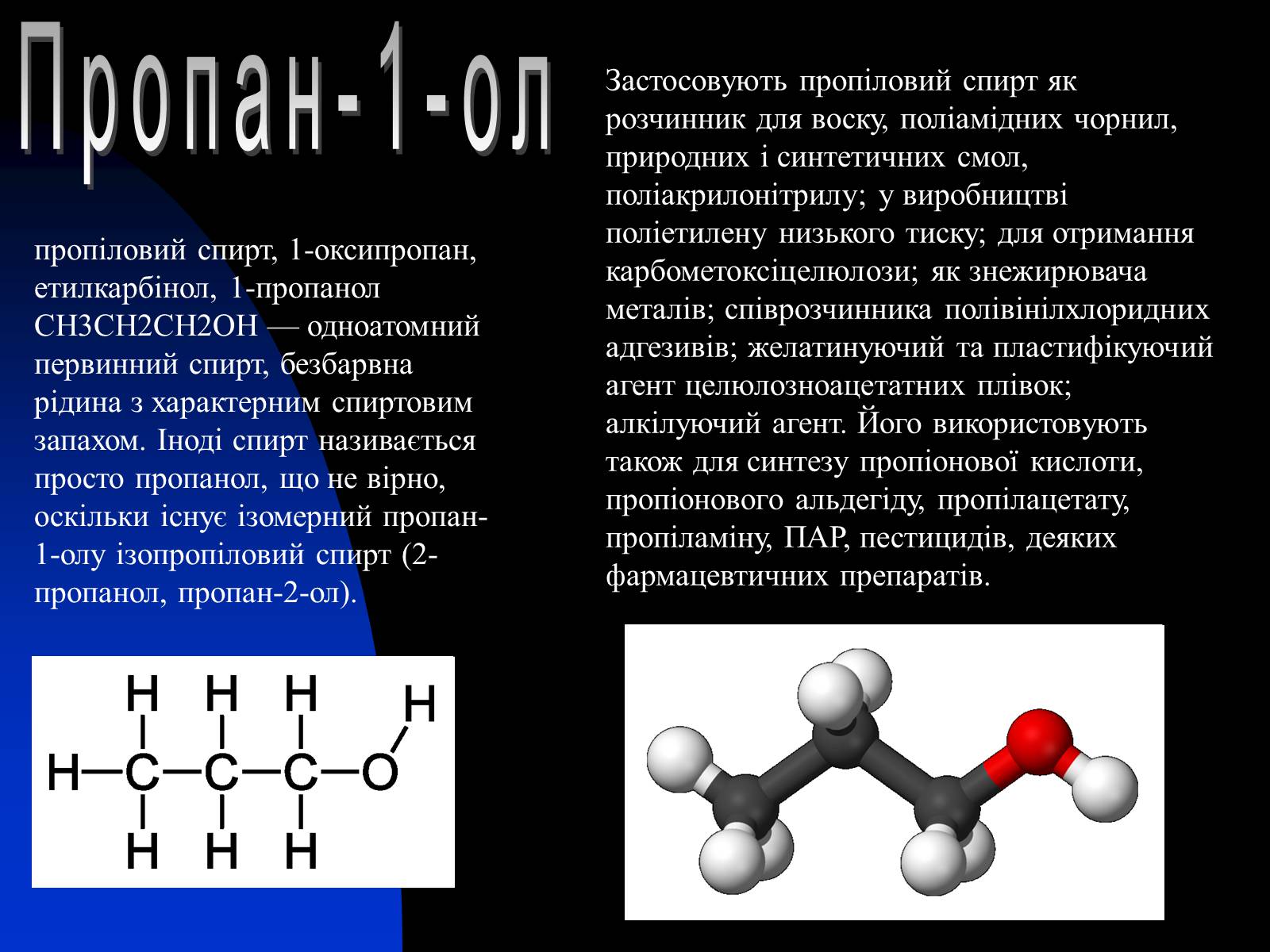
Пропан-1-ол
пропіловий спирт, 1-оксипропан, етилкарбінол, 1-пропанол СН3СН2СН2ОН — одноатомний первинний спирт, безбарвна рідина з характерним спиртовим запахом. Іноді спирт називається просто пропанол, що не вірно, оскільки існує ізомерний пропан-1-олу ізопропіловий спирт (2-пропанол, пропан-2-ол).
Застосовують пропіловий спирт як розчинник для воску, поліамідних чорнил, природних і синтетичних смол, поліакрилонітрилу; у виробництві поліетилену низького тиску; для отримання карбометоксіцелюлози; як знежирювача металів; співрозчинника полівінілхлоридних адгезивів; желатинуючий та пластифікуючий агент целюлозноацетатних плівок; алкілуючий агент. Його використовують також для синтезу пропіонової кислоти, пропіонового альдегіду, пропілацетату, пропіламіну, ПАР, пестицидів, деяких фармацевтичних препаратів.
пропіловий спирт, 1-оксипропан, етилкарбінол, 1-пропанол СН3СН2СН2ОН — одноатомний первинний спирт, безбарвна рідина з характерним спиртовим запахом. Іноді спирт називається просто пропанол, що не вірно, оскільки існує ізомерний пропан-1-олу ізопропіловий спирт (2-пропанол, пропан-2-ол).
Застосовують пропіловий спирт як розчинник для воску, поліамідних чорнил, природних і синтетичних смол, поліакрилонітрилу; у виробництві поліетилену низького тиску; для отримання карбометоксіцелюлози; як знежирювача металів; співрозчинника полівінілхлоридних адгезивів; желатинуючий та пластифікуючий агент целюлозноацетатних плівок; алкілуючий агент. Його використовують також для синтезу пропіонової кислоти, пропіонового альдегіду, пропілацетату, пропіламіну, ПАР, пестицидів, деяких фармацевтичних препаратів.
Слайд #9
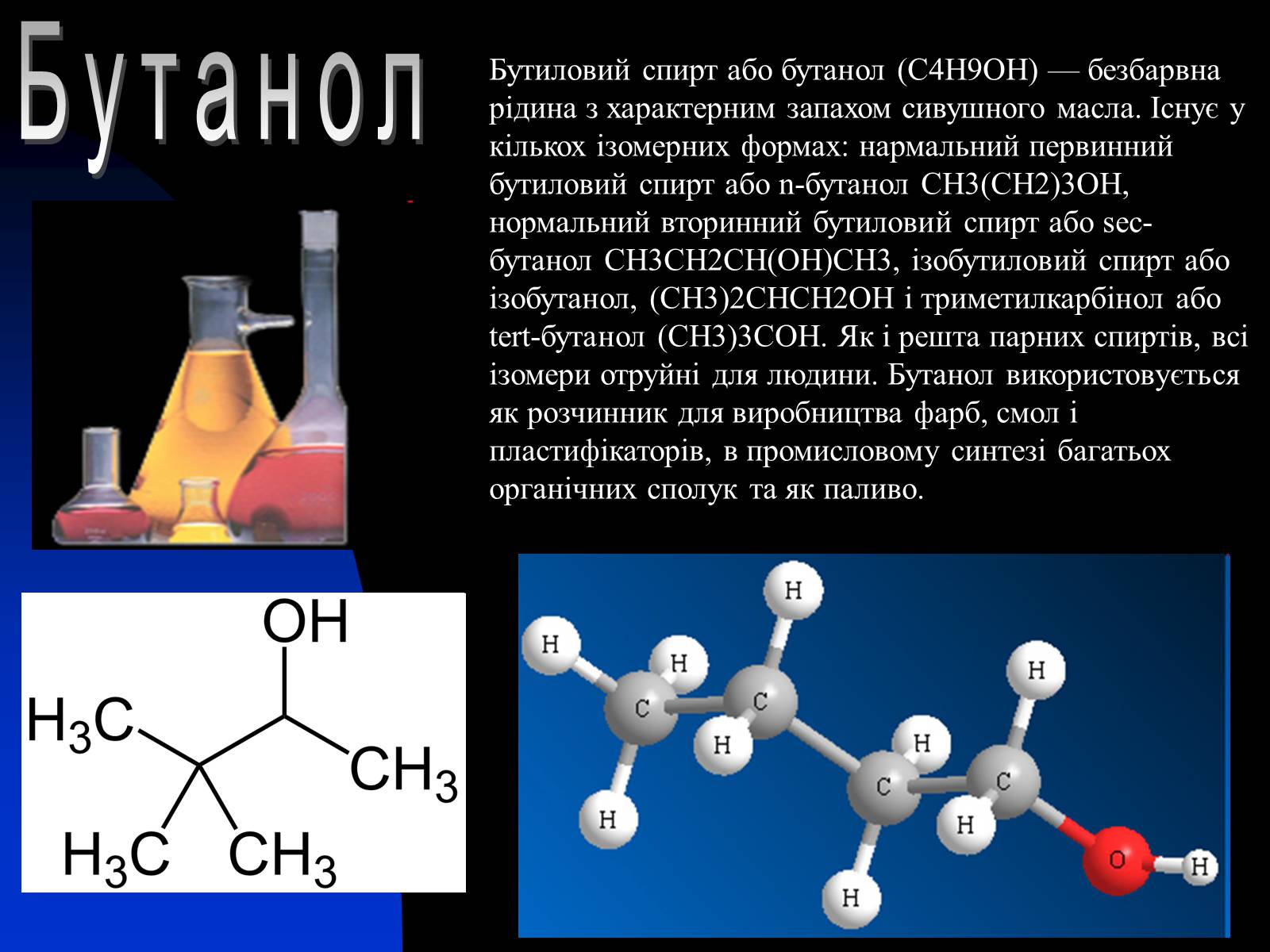
Бутанол
Бутиловий спирт або бутанол (C4H9OH) — безбарвна рідина з характерним запахом сивушного масла. Існує у кількох ізомерних формах: нармальний первинний бутиловий спирт або n-бутанол СН3(СН2)3ОН, нормальний вторинний бутиловий спирт або sec-бутанол СН3СН2СН(ОН)СН3, ізобутиловий спирт або ізобутанол, (СН3)2СНСН2ОН і триметилкарбінол або tert-бутанол (СН3)3СОН. Як і решта парних спиртів, всі ізомери отруйні для людини. Бутанол використовується як розчинник для виробництва фарб, смол і пластифікаторів, в промисловому синтезі багатьох органічних сполук та як паливо.
Бутиловий спирт або бутанол (C4H9OH) — безбарвна рідина з характерним запахом сивушного масла. Існує у кількох ізомерних формах: нармальний первинний бутиловий спирт або n-бутанол СН3(СН2)3ОН, нормальний вторинний бутиловий спирт або sec-бутанол СН3СН2СН(ОН)СН3, ізобутиловий спирт або ізобутанол, (СН3)2СНСН2ОН і триметилкарбінол або tert-бутанол (СН3)3СОН. Як і решта парних спиртів, всі ізомери отруйні для людини. Бутанол використовується як розчинник для виробництва фарб, смол і пластифікаторів, в промисловому синтезі багатьох органічних сполук та як паливо.
Слайд #10
Реакції спиртів
Кислотно-основні властивості
Характерною хімічною властивістю спиртів є їх здатність взаємодіяти з лужними металами і заміщувати гідроксильні атоми водню атомами металу з утворенням речовин, які називають алкоголятами.
Інші атоми водню, що зв'язані безпосередньо з вуглецем, в реакцію не вступають. На прикладі цих реакцій ми вперше . зустрічаємось з явищем впливу одних атомів на інші в молекулі. Суть цього впливу розглянемо на прикладі молекули етилового спирту, електронну будову якої можна зобразити в такому вигляді:
Як видно з цієї формули, гідроксильний атом водню займає в молекулі особливе положення. На відміну від інших атомів водню, він не безпосередньо зв'язаний з атомом вуглецю, а через кисень. Атом кисню як більш активний елемент у більшій мірі, ніж вуглець, відтягує до себе спільну електронну пару. Внаслідок цього гідроксильний атом водню слабіше зв'язаний в молекулі, ніж інші атоми водню, і є більш «рухливим», тому порівняно легко витісняється металом. Реакції спиртів з металами в дечому нагадують реакції кислот з металами. В молекулах спиртів гідроксильні атоми водню значно тісніше зв'язані з киснем, ніж у молекулах кислот. Тому спирти на відміну від кислот не дисоціюють і іонів водню не утворюють.
Кислотно-основні властивості
Характерною хімічною властивістю спиртів є їх здатність взаємодіяти з лужними металами і заміщувати гідроксильні атоми водню атомами металу з утворенням речовин, які називають алкоголятами.
Інші атоми водню, що зв'язані безпосередньо з вуглецем, в реакцію не вступають. На прикладі цих реакцій ми вперше . зустрічаємось з явищем впливу одних атомів на інші в молекулі. Суть цього впливу розглянемо на прикладі молекули етилового спирту, електронну будову якої можна зобразити в такому вигляді:
Як видно з цієї формули, гідроксильний атом водню займає в молекулі особливе положення. На відміну від інших атомів водню, він не безпосередньо зв'язаний з атомом вуглецю, а через кисень. Атом кисню як більш активний елемент у більшій мірі, ніж вуглець, відтягує до себе спільну електронну пару. Внаслідок цього гідроксильний атом водню слабіше зв'язаний в молекулі, ніж інші атоми водню, і є більш «рухливим», тому порівняно легко витісняється металом. Реакції спиртів з металами в дечому нагадують реакції кислот з металами. В молекулах спиртів гідроксильні атоми водню значно тісніше зв'язані з киснем, ніж у молекулах кислот. Тому спирти на відміну від кислот не дисоціюють і іонів водню не утворюють.

Слайд #11
Реакції спиртів
Дегідратація
Для спиртів характерним є також реакції дегідратації (відщеплення води). Так, при нагріванні вище 160°С етилового спирту з надлишком концентрованої сульфатної кислоти як водовіднімаючого засобу від одної молекули спирту відщеплюється одна молекула води і етиловий спирт перетворюється в етилен:
При слабішому нагріванні (близько 140°С) суміші етилового спирту з сульфатною кислотою при надлишку спирту молекула води відщеплюється не від однієї, а від двох молекул спирту, внаслідок чого утворюється не етилен, а діетиловий ефір:
Дегідратація
Для спиртів характерним є також реакції дегідратації (відщеплення води). Так, при нагріванні вище 160°С етилового спирту з надлишком концентрованої сульфатної кислоти як водовіднімаючого засобу від одної молекули спирту відщеплюється одна молекула води і етиловий спирт перетворюється в етилен:
При слабішому нагріванні (близько 140°С) суміші етилового спирту з сульфатною кислотою при надлишку спирту молекула води відщеплюється не від однієї, а від двох молекул спирту, внаслідок чого утворюється не етилен, а діетиловий ефір:

Слайд #12
Реакції спиртів
Естерифікація
Крім того, для спиртів характерні також реакції взаємодії з кислотами, внаслідок чого утворюються складні ефіри. При цьому за рахунок гідроксильної групи кислоти і гідроксильного атома водню спирту утворюється молекула води, а за рахунок залишків молекул кислоти і спирту — молекули складного ефіру. Наприклад, при легкому нагріванні (не вище 100°С) етилового спирту з сульфатною кислотою утворюється сульфатноетиловий ефір або діетилсульфат:
Естерифікація
Крім того, для спиртів характерні також реакції взаємодії з кислотами, внаслідок чого утворюються складні ефіри. При цьому за рахунок гідроксильної групи кислоти і гідроксильного атома водню спирту утворюється молекула води, а за рахунок залишків молекул кислоти і спирту — молекули складного ефіру. Наприклад, при легкому нагріванні (не вище 100°С) етилового спирту з сульфатною кислотою утворюється сульфатноетиловий ефір або діетилсульфат:

Слайд #13
Застосування спиртів
Економічне значення та напрями використання спиртів
Області використання спиртів численні та різноманітні, особливо враховуючи найширший спектр сполук, що відносяться до цього класу. Разом з тим, з промислової точки зору, тільки невеликий ряд спиртів вносить помітний внесок у глобальну світову економіку.
В TOP 50 за 2002 рік сполук, що випускаються хімічною промисловістю США, зі спиртів входять тільки метанол (14-е місце) та етиленгліколь (29-е місце). У наступні 50 найважливіших хімічних сполук, за даними за 1999 рік, включені ізопропіловий спирт, н-бутиловий спирт, синтетичний етанол, пропіленгліколь, діетиленгліколь, 2-етілгексанол, 1,4-бутандіол, сорбітол і гліцерин.
Економічне значення та напрями використання спиртів
Області використання спиртів численні та різноманітні, особливо враховуючи найширший спектр сполук, що відносяться до цього класу. Разом з тим, з промислової точки зору, тільки невеликий ряд спиртів вносить помітний внесок у глобальну світову економіку.
В TOP 50 за 2002 рік сполук, що випускаються хімічною промисловістю США, зі спиртів входять тільки метанол (14-е місце) та етиленгліколь (29-е місце). У наступні 50 найважливіших хімічних сполук, за даними за 1999 рік, включені ізопропіловий спирт, н-бутиловий спирт, синтетичний етанол, пропіленгліколь, діетиленгліколь, 2-етілгексанол, 1,4-бутандіол, сорбітол і гліцерин.

Слайд #14
Застосування спиртів
Економічне значення та напрями використання спиртів
У світі найбільше значення з алканолів мають метиловий, етиловий, пропіловий, ізопропіловий спирт, а також бутилові, амілові і вищі жирні спирти. З циклічних і ароматичних спиртів: циклогексанол, 2-етилгексанол, фенілетиловий і бензиловий спирти; з гликолей і поліолів: етиленгліколь, пропіленгліколь, діетиленгліколь, гліцерин, пентаеритрит.
Найбільш великотоннажними напрямками використання спиртів є (в довільному порядку):
проміжні продукти для основного органічного синтезу
застосування в якості палива
виробництво розчинників
виробництво синтетичних миючих засобів, парфумерії та косметики;
використання в харчовій і фармацевтичній промисловості.
Економічне значення та напрями використання спиртів
У світі найбільше значення з алканолів мають метиловий, етиловий, пропіловий, ізопропіловий спирт, а також бутилові, амілові і вищі жирні спирти. З циклічних і ароматичних спиртів: циклогексанол, 2-етилгексанол, фенілетиловий і бензиловий спирти; з гликолей і поліолів: етиленгліколь, пропіленгліколь, діетиленгліколь, гліцерин, пентаеритрит.
Найбільш великотоннажними напрямками використання спиртів є (в довільному порядку):
проміжні продукти для основного органічного синтезу
застосування в якості палива
виробництво розчинників
виробництво синтетичних миючих засобів, парфумерії та косметики;
використання в харчовій і фармацевтичній промисловості.

Слайд #15
Застосування спиртів
Застосування спиртів як паливо
Для паливних цілей в даний момент використовуються в промислових об'ємах три спирту: метанол, етанол і бутанол, що пов'язано, насамперед, з їх комерційною доступністю та можливістю масового виробництва з рослинної сировини (крім метанолу). При цьому можливе використання спиртів у вигляді пального в чистому вигляді, у вигляді різних сумішей з бензином або дизельним паливом, а також як добавок (до 10%) з метою підвищення октанового числа і зниження токсичності відпрацьованих газів. Також окремим напрямом є використання метанолу для переетерифікації жирів у виробництві біодизеля.
Переважним паливним спиртом є етанол. За оцінками експертів, на 2009 рік 80-90% всього виробленого в світі етилового спирту було використано саме в цих цілях і склало 73,9 млрд літрів (≈ 58 млн тонн).
Застосування спиртів як паливо
Для паливних цілей в даний момент використовуються в промислових об'ємах три спирту: метанол, етанол і бутанол, що пов'язано, насамперед, з їх комерційною доступністю та можливістю масового виробництва з рослинної сировини (крім метанолу). При цьому можливе використання спиртів у вигляді пального в чистому вигляді, у вигляді різних сумішей з бензином або дизельним паливом, а також як добавок (до 10%) з метою підвищення октанового числа і зниження токсичності відпрацьованих газів. Також окремим напрямом є використання метанолу для переетерифікації жирів у виробництві біодизеля.
Переважним паливним спиртом є етанол. За оцінками експертів, на 2009 рік 80-90% всього виробленого в світі етилового спирту було використано саме в цих цілях і склало 73,9 млрд літрів (≈ 58 млн тонн).

Слайд #16
Дякую за увагу!
Над презентацією працював учень 9-А класу
Шевченко Тарас
Сподіваюсь.. Вам сподобалось!
Над презентацією працював учень 9-А класу
Шевченко Тарас
Сподіваюсь.. Вам сподобалось!
