- Головна
- Готові шкільні презентації
- Презентація на тему «Спирты» (варіант 1)
Презентація на тему «Спирты» (варіант 1)
220
Слайд #1
Тема : Спирты
Презентация по химии
Ученицы 11 «Б» класса
ЗОШ №41
Зануды Татьяны
Презентация по химии
Ученицы 11 «Б» класса
ЗОШ №41
Зануды Татьяны

Слайд #2
Содержание
Общая справка
Классификация спиртов
Номенклатура спиртов
История открытия спиртов
Нахождение спиртов в природе
Физические свойства
Химические свойства
Применение спиртов
Общая справка
Классификация спиртов
Номенклатура спиртов
История открытия спиртов
Нахождение спиртов в природе
Физические свойства
Химические свойства
Применение спиртов

Слайд #3
Общая справка
Спирты — органические соединения, содержащие одну или несколько гидроксильных групп (гидроксил, OH), непосредственно связанных с насыщенным атомом углерода, находящемся в состоянии sp3 гибридизации. Спирты можно рассматривать как производные воды H2O, в которых один атом водорода замещен на органическую функциональную группу: R-OH.
Если гидроксильная группа связана с углеродом, находящемся в состоянии sp2 гибридизации, такие соединения называют енолы; если гидроксильная группа связана напрямую с бензольным кольцом, такие соединения называют фенолы.
Спирты являются обширным и очень разнообразным классом органических соединений: они широко распространены в природе, имеют важнейшее промышленное значение и обладают исключительными химическими свойствами.
Спирты — органические соединения, содержащие одну или несколько гидроксильных групп (гидроксил, OH), непосредственно связанных с насыщенным атомом углерода, находящемся в состоянии sp3 гибридизации. Спирты можно рассматривать как производные воды H2O, в которых один атом водорода замещен на органическую функциональную группу: R-OH.
Если гидроксильная группа связана с углеродом, находящемся в состоянии sp2 гибридизации, такие соединения называют енолы; если гидроксильная группа связана напрямую с бензольным кольцом, такие соединения называют фенолы.
Спирты являются обширным и очень разнообразным классом органических соединений: они широко распространены в природе, имеют важнейшее промышленное значение и обладают исключительными химическими свойствами.

Слайд #4
1. Классификация спиртов.
Типы классификации спиртов.
1) По числу гидроксильных групп:
Одноатомные, двухатомные(гликоли), трехатомные и многоатомные спирты
2) По характеру углеводородного радикала:
Предельные, непредельные, ароматические
3) По характеру атома углерода, с
которым связана гидроксильная группа:
Первичные, вторичные, третичные
Типы классификации спиртов.
1) По числу гидроксильных групп:
Одноатомные, двухатомные(гликоли), трехатомные и многоатомные спирты
2) По характеру углеводородного радикала:
Предельные, непредельные, ароматические
3) По характеру атома углерода, с
которым связана гидроксильная группа:
Первичные, вторичные, третичные

Слайд #5
Номенклатура спиртов
Для распространенных спиртов, имеющих простое строение, используют упрощенную номенклатуру: название органической группы преобразуют в прилагательное (с помощью суффикса и окончания «овый») и добавляют слово «спирт»:
СН3ОНt метиловый спирт
С2Н5ОНt этиловый спирт
(Н3С)2СНОНt изопропиловый спирт
С4Н9ОНt бутиловый спирт
Для распространенных спиртов, имеющих простое строение, используют упрощенную номенклатуру: название органической группы преобразуют в прилагательное (с помощью суффикса и окончания «овый») и добавляют слово «спирт»:
СН3ОНt метиловый спирт
С2Н5ОНt этиловый спирт
(Н3С)2СНОНt изопропиловый спирт
С4Н9ОНt бутиловый спирт

Слайд #6
В том случае, когда строение органической группы более сложное, используют общие для всей органической химии правила. Названия, составленные по таким правилам, называют систематическими. В соответствии с этими правилами, углеводородную цепь нумеруют с того конца, к которому ближе расположена ОН-группа. Далее используют эту нумерацию, чтобы указать положение различных заместителей вдоль основной цепи, в конце названия добавляют суффикс «ол» и цифру, указывающую положение ОН-группы.
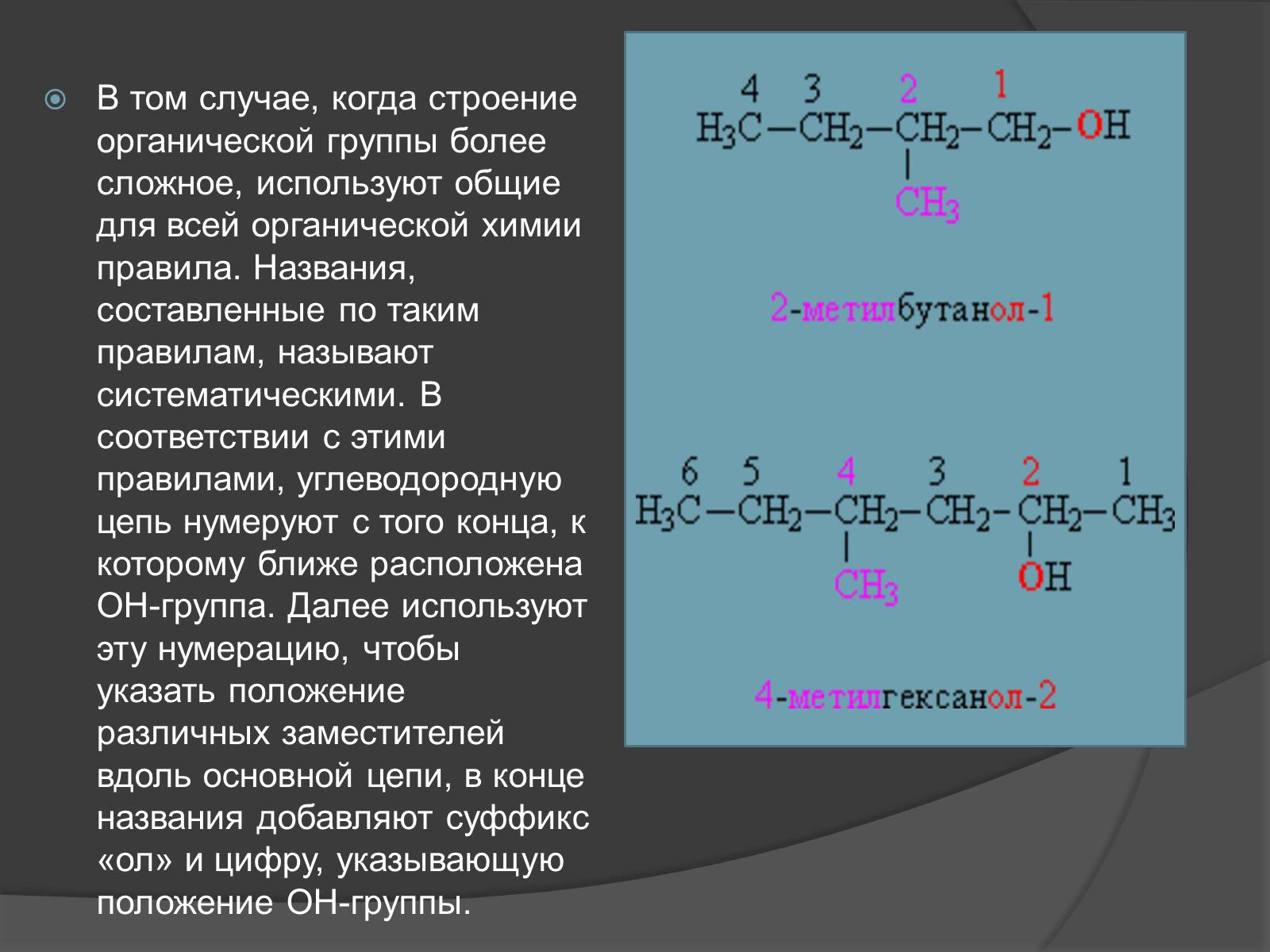
Слайд #7
Функциональные (ОН) и замещающие (СН3) группы, а также соответствующие им цифровые индексы выделены различающимися цветами.
Систематические названия простейших спиртов составляют по тем же правилам: метанол, этанол, бутанол. Для некоторых спиртов сохранились тривиальные (упрощенные) названия, сложившиеся исторически: пропаргиловый спирт НСєС–СН2–ОН, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4, фенетиловый спирт С6Н5–CH2–CH2–OH.
Систематические названия простейших спиртов составляют по тем же правилам: метанол, этанол, бутанол. Для некоторых спиртов сохранились тривиальные (упрощенные) названия, сложившиеся исторически: пропаргиловый спирт НСєС–СН2–ОН, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4, фенетиловый спирт С6Н5–CH2–CH2–OH.

Слайд #8
Историческая справка
Слово «спирт» происходит от древнего латинского названия этого вещества – spiritus vini («дух вина»). Этот термин до сих пор используется в медицине при записи рецептов. В XVI веке в западноевропейских языках, а в XVIII веке и в русском у винного (этилового) спирта появилось новое название – алкоголь (араб. «ал-кугул»).
Безводный (абсолютный) этиловый спирт был впервые получен лишь в 1796 году российским химиком Товием Егоровичем Ловицем и немецким учёным Иеремием Вениамином Рихтером. Для этой цели они применяли вещества, связывающие воду, например оксид кальция (негашёную известь). Абсолютный спирт легко поглощает влагу воздуха, поэтому его хранят в плотно закрытых сосудах.
Слово «спирт» происходит от древнего латинского названия этого вещества – spiritus vini («дух вина»). Этот термин до сих пор используется в медицине при записи рецептов. В XVI веке в западноевропейских языках, а в XVIII веке и в русском у винного (этилового) спирта появилось новое название – алкоголь (араб. «ал-кугул»).
Безводный (абсолютный) этиловый спирт был впервые получен лишь в 1796 году российским химиком Товием Егоровичем Ловицем и немецким учёным Иеремием Вениамином Рихтером. Для этой цели они применяли вещества, связывающие воду, например оксид кальция (негашёную известь). Абсолютный спирт легко поглощает влагу воздуха, поэтому его хранят в плотно закрытых сосудах.

Слайд #9
Нахождение спиртов в природе
Спирты имеют самое широкое распространение в природе, особенно в виде сложных эфиров, однако и в свободном состоянии их можно встретить достаточно часто.
Метиловый спирт в небольшом количестве содержится в некоторых растениях, например: борщевике (Heracleum).
Этиловый спирт — естественный продукт спиртового брожения органических продуктов, содержащих углеводороды, часто образующийся в прокисших ягодах и фруктах без всякого участия человека. Кроме того, этанол является естественным метаболитом и содержится в тканях и крови животных и человека.
Спирты имеют самое широкое распространение в природе, особенно в виде сложных эфиров, однако и в свободном состоянии их можно встретить достаточно часто.
Метиловый спирт в небольшом количестве содержится в некоторых растениях, например: борщевике (Heracleum).
Этиловый спирт — естественный продукт спиртового брожения органических продуктов, содержащих углеводороды, часто образующийся в прокисших ягодах и фруктах без всякого участия человека. Кроме того, этанол является естественным метаболитом и содержится в тканях и крови животных и человека.

Слайд #10
В эфирных маслах зеленых частей многих растений содержится 3(Z)-Гексен-1-ол («спирт листьев»), придающий им характерный запах.Фенилэтиловый спирт — душистый компонент розового эфирного масла.Очень широко представлены в растительном мире терпеновые спирты, многие из которых являются душистыми веществами,

Слайд #11
Физические свойства спиртов
Спирты растворимы в большинстве органических растворителей. При увеличении количества атомов С в органической группе начинает сказываться гидрофобный (водоотталкивающий) эффект, растворимость в воде становится ограниченной.
Благодаря наличию ОН-групп между молекулами спиртов возникают водородные связи.
В результате у всех спиртов более высокая температура кипения, чем у соответствующих углеводородов .
Рис. 5. ВОДОРОДНЫЕ СВЯЗИ В СПИРТАХ (показаны пунктиром)
Спирты растворимы в большинстве органических растворителей. При увеличении количества атомов С в органической группе начинает сказываться гидрофобный (водоотталкивающий) эффект, растворимость в воде становится ограниченной.
Благодаря наличию ОН-групп между молекулами спиртов возникают водородные связи.
В результате у всех спиртов более высокая температура кипения, чем у соответствующих углеводородов .
Рис. 5. ВОДОРОДНЫЕ СВЯЗИ В СПИРТАХ (показаны пунктиром)

Слайд #12
1. Взаимодействие спиртов со щелочными и щелочноземельными металлами
2Na + 2H2O= 2NaOH + H2
2Na + 2C2H5OH = 2C2H5ONa +H2
2Na + 2ROH = 2RONa + H2
2. Взаимодействие спиртов с гологеноводородами (после замещения гидроксильной группы на галоген получается галогеноалкан)
C2H5OH + HBr C2H5Br +H2O
3. Межмолекулярная дегидратация спиртов ( Отщепление молекул воды от двух молекул спирта при нагревании водоотнимающих средств. В результате образуются простые эфиры)
R - OH + HO - R H2SO4(конц.) R – O - R + H2O
А при нагревании этилового спирта с серной кислотой до температуры от 100 до 140 градусов Цельсия образуется диэтиловый (серный) эфир
C2H5OH + HOC2H5 H2SO4 (Конц.), t< 140 C2H5 – O – C2H5 + H2O
4. Взаимодействие спиртов с органическими и неорганическими кислотами (с образованием сложных эфиров, по-другому, реакция этерификации)
O O
R1 – OH + C – R2 R2 - C + H2O
HO O – R
Спирт Карбоновая Сложный эфир
кислота
Химические свойства спиртов
2Na + 2H2O= 2NaOH + H2
2Na + 2C2H5OH = 2C2H5ONa +H2
2Na + 2ROH = 2RONa + H2
2. Взаимодействие спиртов с гологеноводородами (после замещения гидроксильной группы на галоген получается галогеноалкан)
C2H5OH + HBr C2H5Br +H2O
3. Межмолекулярная дегидратация спиртов ( Отщепление молекул воды от двух молекул спирта при нагревании водоотнимающих средств. В результате образуются простые эфиры)
R - OH + HO - R H2SO4(конц.) R – O - R + H2O
А при нагревании этилового спирта с серной кислотой до температуры от 100 до 140 градусов Цельсия образуется диэтиловый (серный) эфир
C2H5OH + HOC2H5 H2SO4 (Конц.), t< 140 C2H5 – O – C2H5 + H2O
4. Взаимодействие спиртов с органическими и неорганическими кислотами (с образованием сложных эфиров, по-другому, реакция этерификации)
O O
R1 – OH + C – R2 R2 - C + H2O
HO O – R
Спирт Карбоновая Сложный эфир
кислота
Химические свойства спиртов

Слайд #13
5. Внутримолекулярная дегидратация спиртов (В результате происходит получение алкенов)
CH3 – CH2 – OH H2SO4 (конц.), t>140 CH2 CH2 + H2O
6. Окисление спиртов (Обычно проводят сильными окислителями.)В зависимости от природы спита и условий проведения реакции могут образовыватсься различные продукты. Например первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
[O] O [O] O
CH3 – CH2 – OH CH3 – C CH3 - C
-H2O H OH
При окислении вторичных спиртов образуются кетоны:
[O]
CH3 – CH – CH3 CH3 – C – CH3
OH -H2O O
Третичные спирты достаточно устойчивы к окислению, но в жестких условиях (сильный окислитель, высокая температура) возможно их окисление, происходящее с разрывом углеро-углеродных связей, ближайших к гидроксильной группе.
7. Дегидрирование спиртов ( При пропускании паров спирта при 200-300 градусов Цельсия на металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные в кетоны)
O
R – CH2 – OH Cu, t R – C + H2 (Альдегид)
H
R – CH – R Cu, t R – C – R + H2 (Кетон)
OHO
CH3 – CH2 – OH H2SO4 (конц.), t>140 CH2 CH2 + H2O
6. Окисление спиртов (Обычно проводят сильными окислителями.)В зависимости от природы спита и условий проведения реакции могут образовыватсься различные продукты. Например первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
[O] O [O] O
CH3 – CH2 – OH CH3 – C CH3 - C
-H2O H OH
При окислении вторичных спиртов образуются кетоны:
[O]
CH3 – CH – CH3 CH3 – C – CH3
OH -H2O O
Третичные спирты достаточно устойчивы к окислению, но в жестких условиях (сильный окислитель, высокая температура) возможно их окисление, происходящее с разрывом углеро-углеродных связей, ближайших к гидроксильной группе.
7. Дегидрирование спиртов ( При пропускании паров спирта при 200-300 градусов Цельсия на металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные в кетоны)
O
R – CH2 – OH Cu, t R – C + H2 (Альдегид)
H
R – CH – R Cu, t R – C – R + H2 (Кетон)
OHO

Слайд #14
Применение спиртов.
Способность спиртов участвовать в разнообразных химических реакциях позволяет их использовать для получения всевозможных органических соединений: альдегидов, кетонов, карбоновых кислот простых и сложных эфиров, применяемых в качестве органических растворителей, при производстве полимеров, красителей и лекарственных препаратов.
Способность спиртов участвовать в разнообразных химических реакциях позволяет их использовать для получения всевозможных органических соединений: альдегидов, кетонов, карбоновых кислот простых и сложных эфиров, применяемых в качестве органических растворителей, при производстве полимеров, красителей и лекарственных препаратов.

Слайд #15
Фенетиловый спирт С6Н5–CH2–CH2–OH обладает запахом розы, содержится в розовом масле, его используют в парфюмерии.
Этиленгликоль HOCH2–CH2OH используют в производстве пластмасс и как антифриз (добавка, снижающая температуру замерзания водных растворов), кроме того, при изготовлении текстильных и типографских красок.
Диэтиленгликоль HOCH2–CH2OCH2–CH2OH используют для заполнения тормозных гидравлических приспособлений, а также в текстильной промышленности при отделке и крашении тканей.
Этиленгликоль HOCH2–CH2OH используют в производстве пластмасс и как антифриз (добавка, снижающая температуру замерзания водных растворов), кроме того, при изготовлении текстильных и типографских красок.
Диэтиленгликоль HOCH2–CH2OCH2–CH2OH используют для заполнения тормозных гидравлических приспособлений, а также в текстильной промышленности при отделке и крашении тканей.

Слайд #16
Этанол С2Н5ОН – исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства сложных эфиров карбоновых кислот, используемых в качестве растворителей. Кроме того, этанол – основной компонент всех спиртных напитков, его широко применяют и в медицине как дезинфицирующее средство.

Слайд #17
Метанол СН3ОН используют как растворитель, а также в производстве формальдегида, применяемого для получения фенолформальдегидных смол, в последнее время метанол рассматривают как перспективное моторное топливо. Большие объемы метанола используют при добыче и транспорте природного газа. Метанол – наиболее токсичное соединение среди всех спиртов, смертельная доза при приеме внутрь – 100 мл.

Слайд #18
Бутанол используют как растворитель жиров и смол, кроме того, он служит сырьем для получения душистых веществ (бутилацетата, бутилсалицилата и др.). В шампунях он используется как компонент, повышающий прозрачность растворов.
Бензиловый спирт С6Н5–CH2–OH в свободном состоянии (и в виде сложных эфиров) содержится в эфирных маслах жасмина и гиацинта. Он обладает антисептическими (обеззараживающими) свойствами, в косметике он используется как консервант кремов, лосьонов, зубных эликсиров, а в парфюмерии - как душистое вещество.
Бензиловый спирт С6Н5–CH2–OH в свободном состоянии (и в виде сложных эфиров) содержится в эфирных маслах жасмина и гиацинта. Он обладает антисептическими (обеззараживающими) свойствами, в косметике он используется как консервант кремов, лосьонов, зубных эликсиров, а в парфюмерии - как душистое вещество.

Слайд #19
Глицерин HOCH2–CH(OH)–CH2OH применяют для получения полиэфирных глифталевых смол, кроме того, он является компонентом многих косметических препаратов.
