- Головна
- Готові шкільні презентації
- Презентація на тему «Особенности строения атома карбона в основном и возбужденном состояниях»
Презентація на тему «Особенности строения атома карбона в основном и возбужденном состояниях»
353
Слайд #1
Особенности строения атома карбона в основном и возбужденном состояниях. Образование ковалентных связей между атомами карбона. Структурные формулы органических веществ.
Учитель:
Мельникова И.В.
Учитель:
Мельникова И.В.

Слайд #2
Ответьте на вопросы:
Почему органическую химию называют химией соединений карбона?
Составьте схему строения атома карбона.
Почему органическую химию называют химией соединений карбона?
Составьте схему строения атома карбона.
Слайд #3
Назовите возможные валентности и степени окисления атома карбона?
Почему атомы карбона могут образовывать химические связи друг за другом?
Ответьте на вопросы:
Ответьте на вопросы:
Почему атомы карбона могут образовывать химические связи друг за другом?
Ответьте на вопросы:
Ответьте на вопросы:

Слайд #4
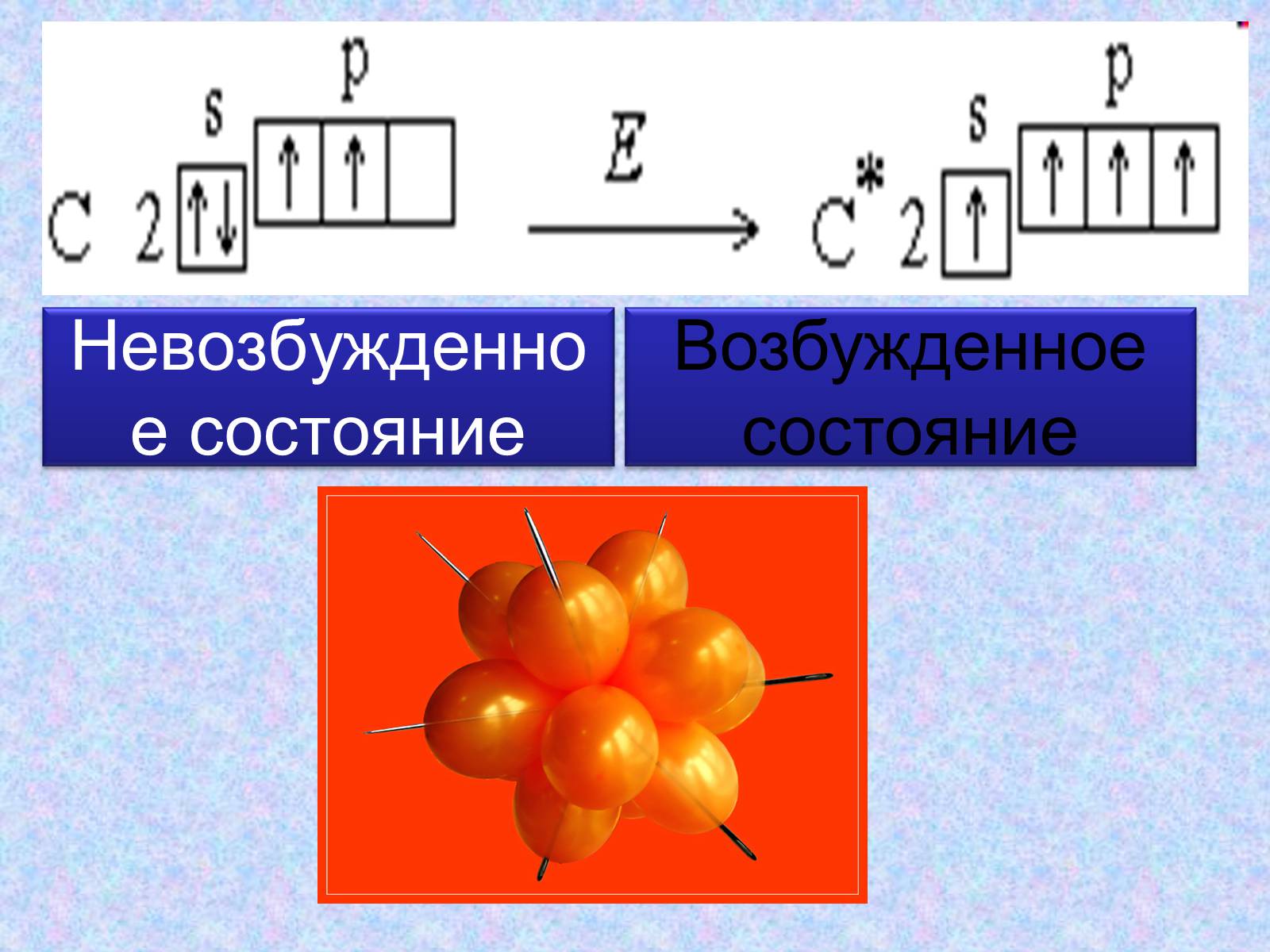
Рассмотрим строение внешнего электронного уровня атома карбона:

Слайд #5
Невозбужденное состояние
Возбужденное состояние
Возбужденное состояние
Слайд #6
Углерод в природе встречается в виде алмаза и графита. В ископаемых углях его содержится: от 92 % - в антраците, до 80 % - в буром угле. В связном состоянии углерод встречается в карбидах: CaCO3 мел, известняк и мрамор, MgCO3·CaCO3 - доломит,
MgCO3 - магнезит. В воздухе углерод содержится в виде углекислого газа (0.03 % по объему). Содержится углерод и в соединениях, растворенных в морской воде. Углерод входит в состав растений и животных, содержится в нефти и природном газе. В реакциях с активными неметаллами углерод легко окисляется:
C+O2=CO2
2C+O2=2CO
C+2S=CS2
C+2F2=CF4
Углерод может проявлять восстановительные свойства и при взаимодействии со сложными веществами:
C+2CuO=Cu+Co2
C+2H2SO4(конц.)=CO2+2SO2+H2O
2C+BaSO4=BaS+2CO2
MgCO3 - магнезит. В воздухе углерод содержится в виде углекислого газа (0.03 % по объему). Содержится углерод и в соединениях, растворенных в морской воде. Углерод входит в состав растений и животных, содержится в нефти и природном газе. В реакциях с активными неметаллами углерод легко окисляется:
C+O2=CO2
2C+O2=2CO
C+2S=CS2
C+2F2=CF4
Углерод может проявлять восстановительные свойства и при взаимодействии со сложными веществами:
C+2CuO=Cu+Co2
C+2H2SO4(конц.)=CO2+2SO2+H2O
2C+BaSO4=BaS+2CO2

Слайд #7
В реакциях с металлами и менее
активными неметаллами углерод -
окислитель:
2C+H2=C2H2
C+Si=SiC
2C+Ca=CaC2
3C+4Al=Al4C3
Карбид алюминия является истинным карбидом: всеми четырьмя валентными
связями каждый атом углерода связан с атомами металла. Карбид кальция
является ацетиленидом, так как между углеродными атомами имеется тройная
связь. Поэтому при взаимодействии карбидов алюминия с водой выделяется
метан, а при взаимодействии карбида кальция с водой - ацетилен
4Al4C3+12H2O=4Al(OH)3+3CH4
CaC2+2H2O=Ca(OH)2 +C2H2
Каменный уголь используется как топливо, применяется для получения синтез-газа. Из графита делают электроды, графитовые стержни используется в качестве замедлителя нейтронов в ядерных реакторах. Алмазы используют для изготовления
режущих инструментов, абразивов, ограненные алмазы (бриллианты) являются драгоценными камнями.
активными неметаллами углерод -
окислитель:
2C+H2=C2H2
C+Si=SiC
2C+Ca=CaC2
3C+4Al=Al4C3
Карбид алюминия является истинным карбидом: всеми четырьмя валентными
связями каждый атом углерода связан с атомами металла. Карбид кальция
является ацетиленидом, так как между углеродными атомами имеется тройная
связь. Поэтому при взаимодействии карбидов алюминия с водой выделяется
метан, а при взаимодействии карбида кальция с водой - ацетилен
4Al4C3+12H2O=4Al(OH)3+3CH4
CaC2+2H2O=Ca(OH)2 +C2H2
Каменный уголь используется как топливо, применяется для получения синтез-газа. Из графита делают электроды, графитовые стержни используется в качестве замедлителя нейтронов в ядерных реакторах. Алмазы используют для изготовления
режущих инструментов, абразивов, ограненные алмазы (бриллианты) являются драгоценными камнями.

Слайд #8
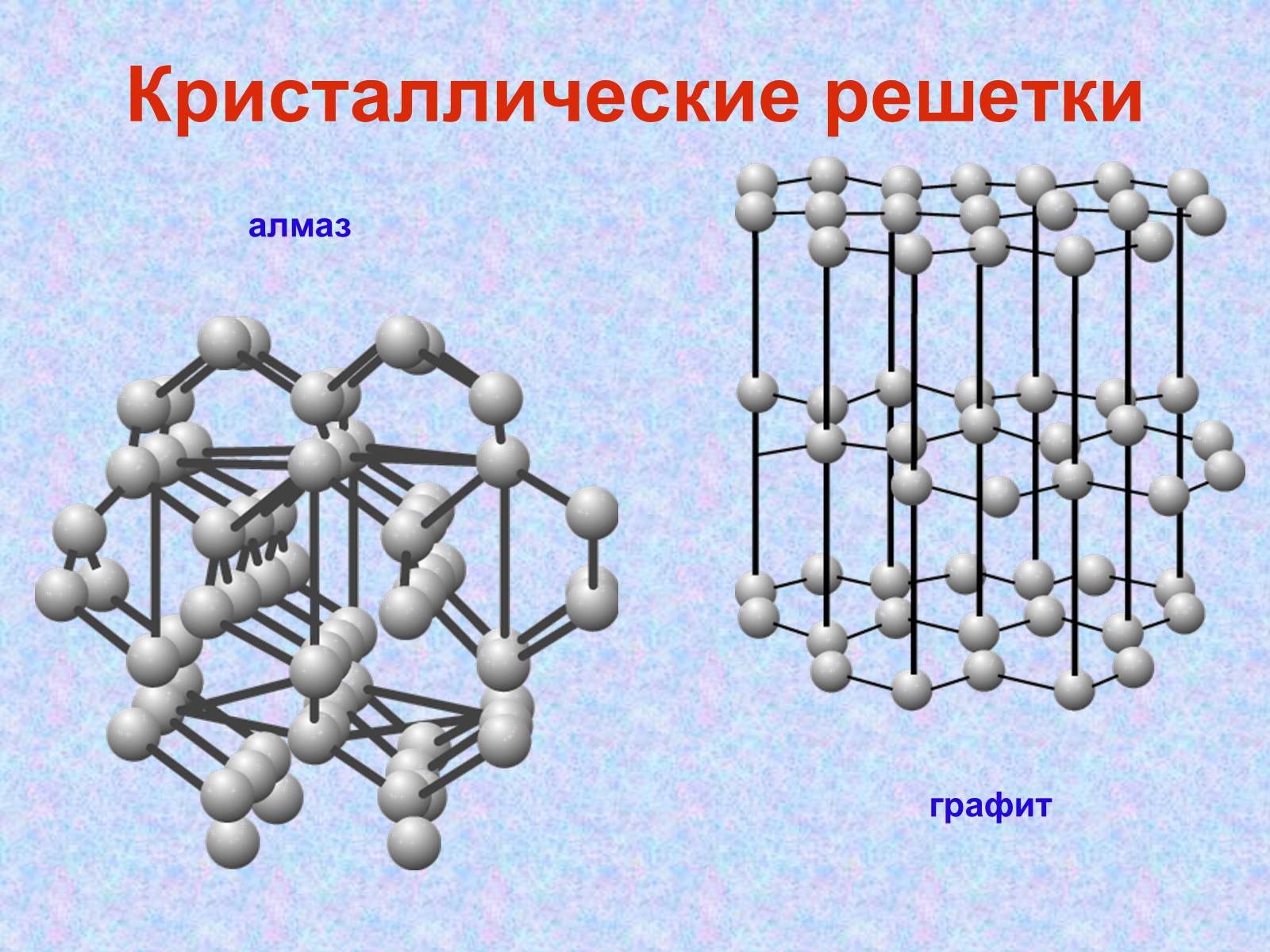
Кристаллические решетки
алмаз
графит
алмаз
графит
Слайд #9
бесцветное кристаллическое вещество с атомной решеткой.
Каждый атом углерода в алмазе окружен четырьмя другими, расположенными от него в направлениях от центра тетраэдра к его вершинам.
Алмаз имеет высокую твердость, плотность 3,5 г/см2, плохо проводит тепло и практически не проводит электрический ток.
Это самое тугоплавкое природное вещество tпл =3730С.
В чистом виде алмаз сильно преломляет свет.
Его применяют как украшение, а также для резки стекла, бурения горных пород и шлифования особо твердых материалов.
Алмаз
Каждый атом углерода в алмазе окружен четырьмя другими, расположенными от него в направлениях от центра тетраэдра к его вершинам.
Алмаз имеет высокую твердость, плотность 3,5 г/см2, плохо проводит тепло и практически не проводит электрический ток.
Это самое тугоплавкое природное вещество tпл =3730С.
В чистом виде алмаз сильно преломляет свет.
Его применяют как украшение, а также для резки стекла, бурения горных пород и шлифования особо твердых материалов.
Алмаз

Слайд #10
Виды алмазов
Хоуп страз
Тиффани
Нассак 90 карат
Принцесса
Орлов
Горняк
Зелёный дрезденский
Хоуп страз
Тиффани
Нассак 90 карат
Принцесса
Орлов
Горняк
Зелёный дрезденский

Слайд #11
Графит
Графит обладает тремя практически важными свойствами:
Тугоплавкость
Отсутствие на его поверхности каких-либо продуктов взаимодействия с окружающей средой, увеличивающих электрическое сопротивление.
Способность оказывать смазывающее действие на трущиеся поверхности.
Графит – серо-черное кристаллическое вещество с металлическим блеском, жирное на ощупь, по твердости уступает даже бумаге.
Графит обладает тремя практически важными свойствами:
Тугоплавкость
Отсутствие на его поверхности каких-либо продуктов взаимодействия с окружающей средой, увеличивающих электрическое сопротивление.
Способность оказывать смазывающее действие на трущиеся поверхности.
Графит – серо-черное кристаллическое вещество с металлическим блеском, жирное на ощупь, по твердости уступает даже бумаге.

Слайд #12
Теория химического строения А.М. Бутлерова
В 1861 году на съезде немецких натуралистов Бутлеров докладывал о новых теориях в органической химии.
В 1861 году на съезде немецких натуралистов Бутлеров докладывал о новых теориях в органической химии.

Слайд #13
Он выдвинул новое понятие – «СТРУКТУРА»
Так родилась теория химического строения
Так родилась теория химического строения

Слайд #14
Основные положения теории:
1. В молекулах веществ существует последовательность химического соединения атомов соответственно их валентности, которая называется химической структурой (строением).
1. В молекулах веществ существует последовательность химического соединения атомов соответственно их валентности, которая называется химической структурой (строением).

Слайд #15
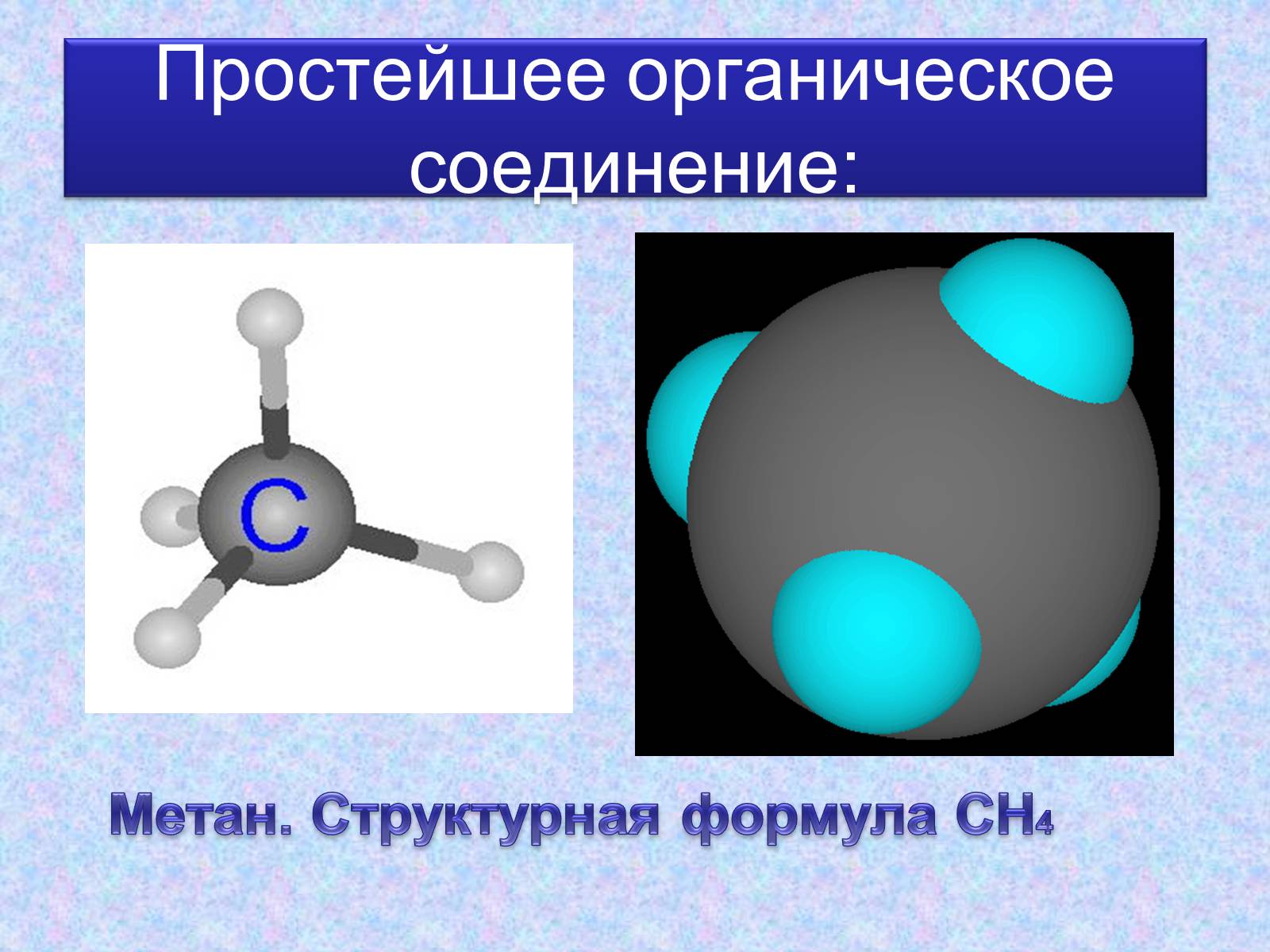
Простейшее органическое соединение:
Метан. Структурная формула СН4
Метан. Структурная формула СН4
Слайд #16
2. Химические особенности веществ определяются природой элементарных составляющих, их количеством и порядком соединения.
Основные положения теории:
Основные положения теории:

Слайд #17
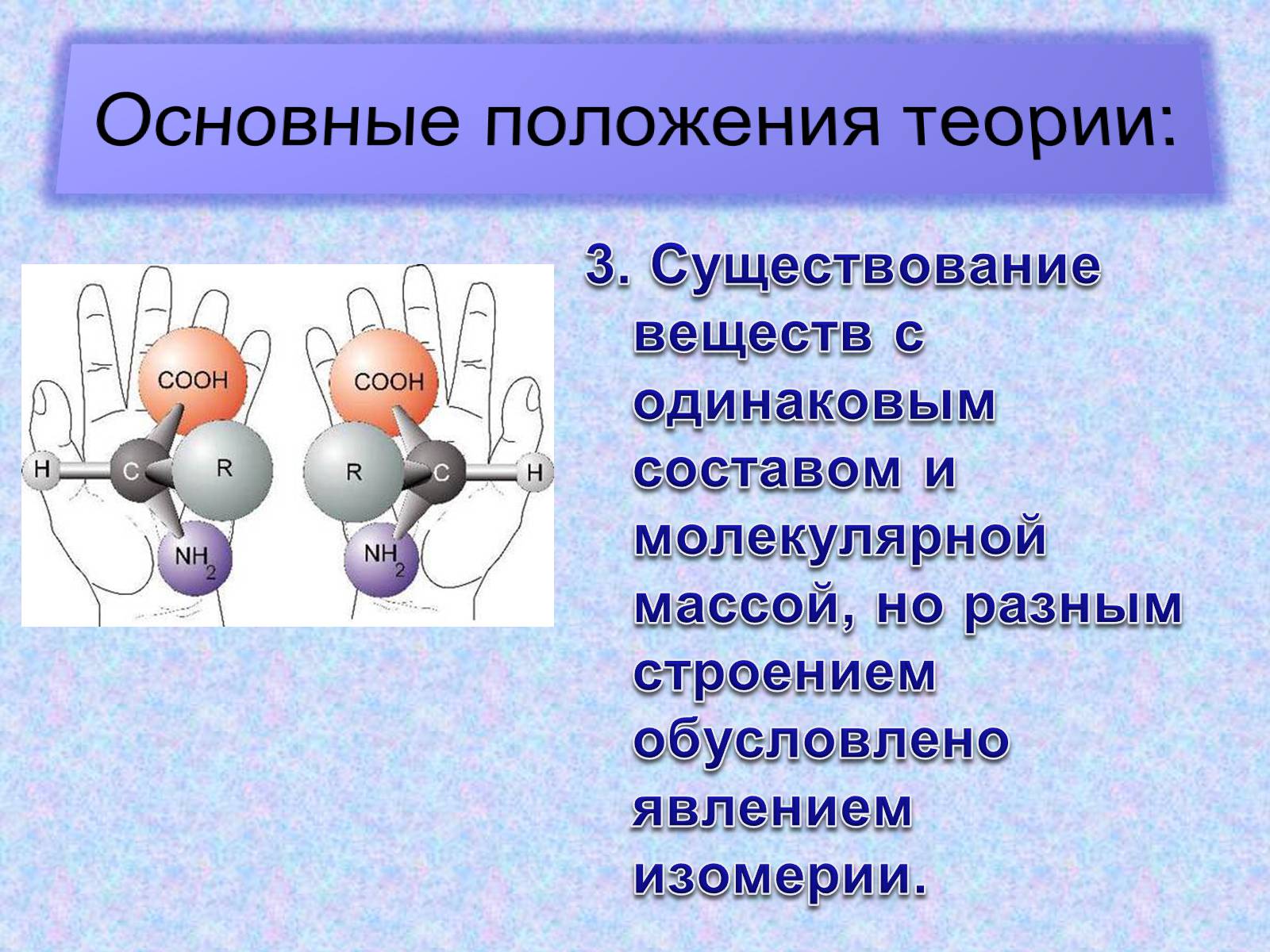
3. Существование веществ с одинаковым составом и молекулярной массой, но разным строением обусловлено явлением изомерии.
Основные положения теории:
Основные положения теории:
Слайд #18
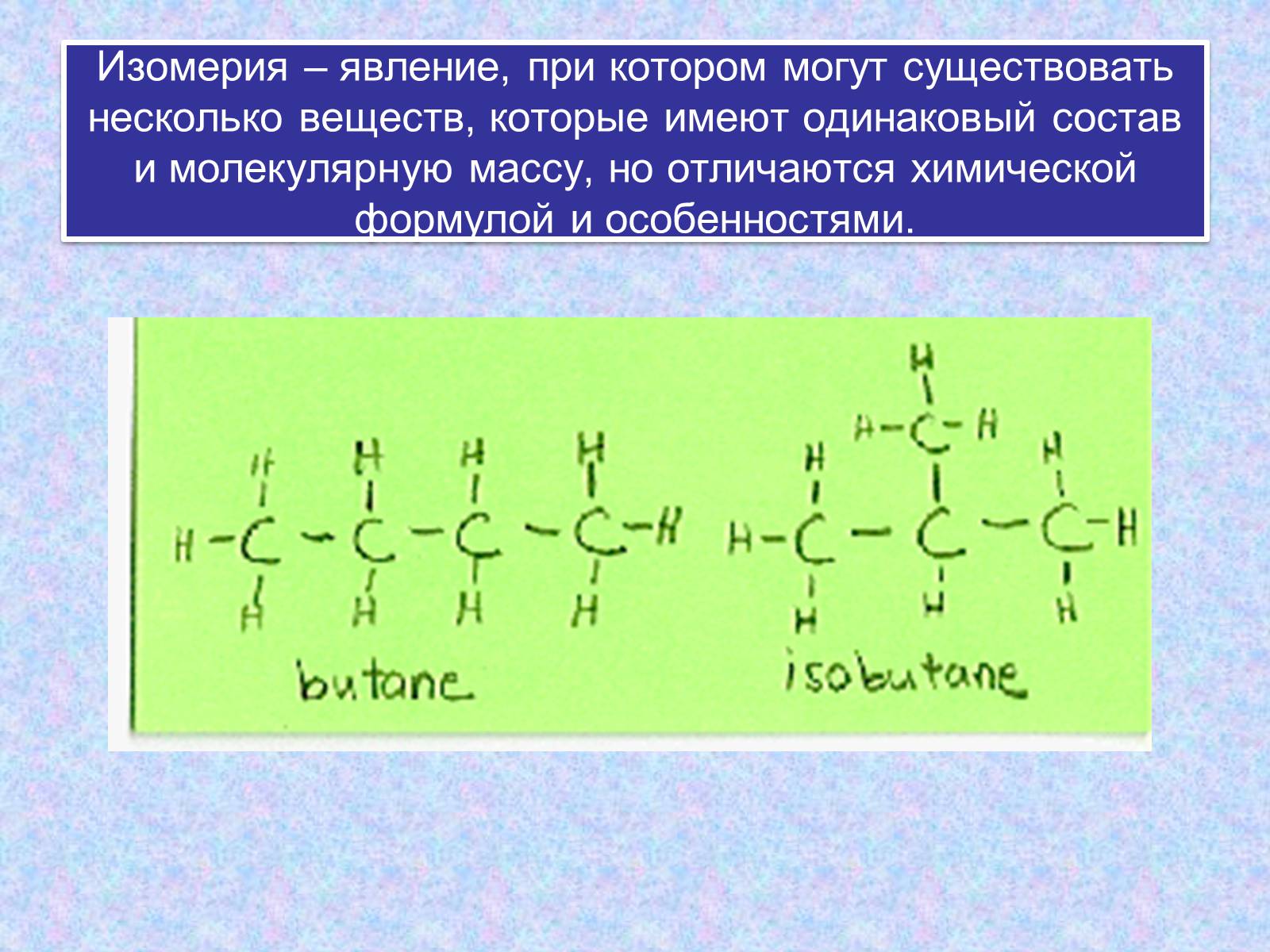
Изомерия – явление, при котором могут существовать несколько веществ, которые имеют одинаковый состав и молекулярную массу, но отличаются химической формулой и особенностями.
Слайд #19
4. Т.к. в конкретных реакциях изменяются только некоторые части молекулы, то исследование строения продукта реакции помогает определить строение молекулы продукта.
Основные положения теории:
Основные положения теории:

Слайд #20
5. Химическая природа отдельных атомов молекулы изменяется в зависимости от окружения, т.е. от того, с какими атомами других элементов они соединены.
Основные положения теории:
Основные положения теории:

Слайд #21
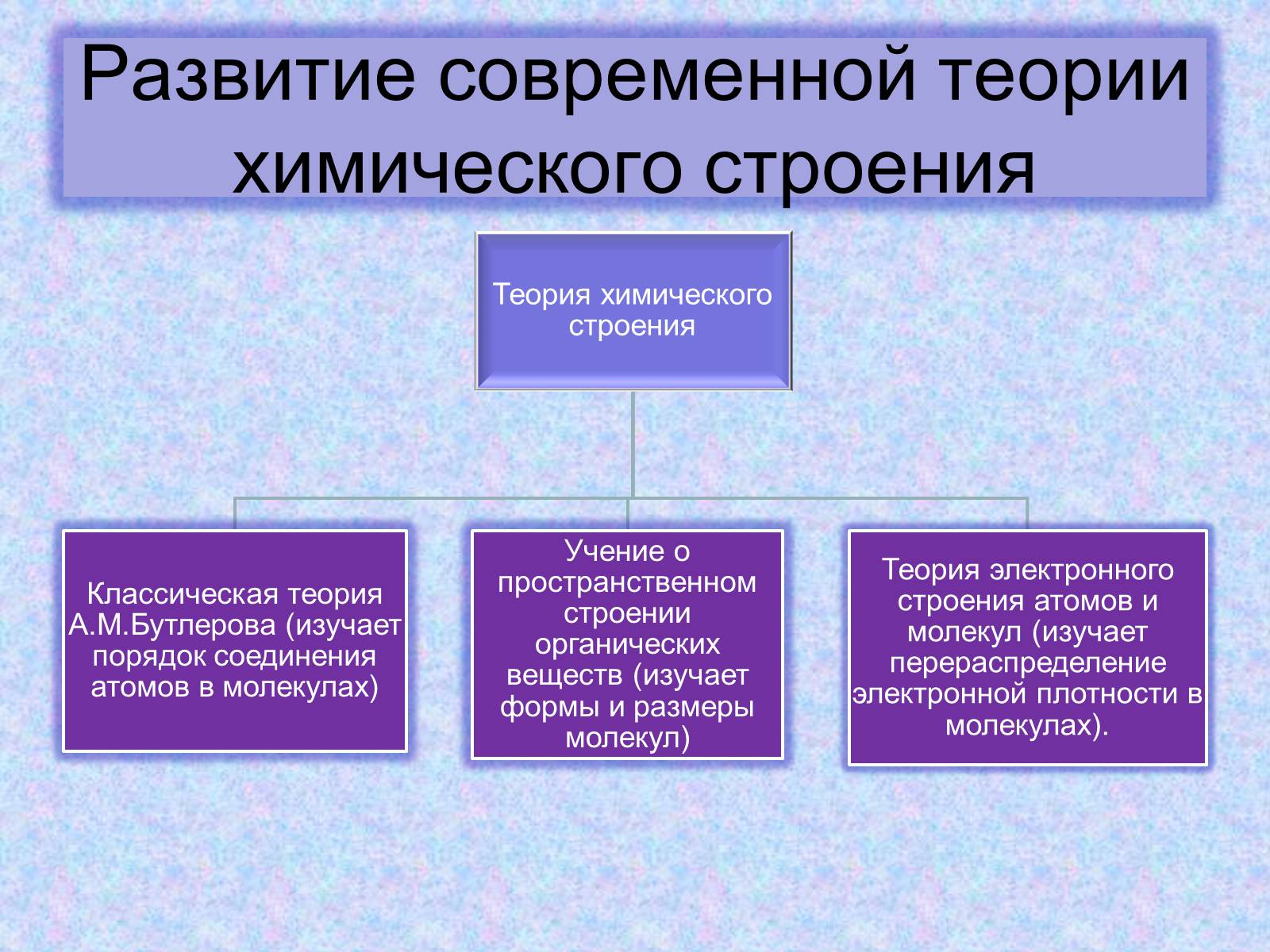
Развитие современной теории химического строения
Слайд #22
Домашнее задание:
Выучить параграф 19;
Ответить на вопросы к нему;
Выполнить упражнения.
Выучить параграф 19;
Ответить на вопросы к нему;
Выполнить упражнения.
