- Головна
- Готові шкільні презентації
- Презентація на тему «Металлы» (варіант 3)
Презентація на тему «Металлы» (варіант 3)
256
Слайд #1
Способы получения металлов
Металлы
Металлы

Слайд #2
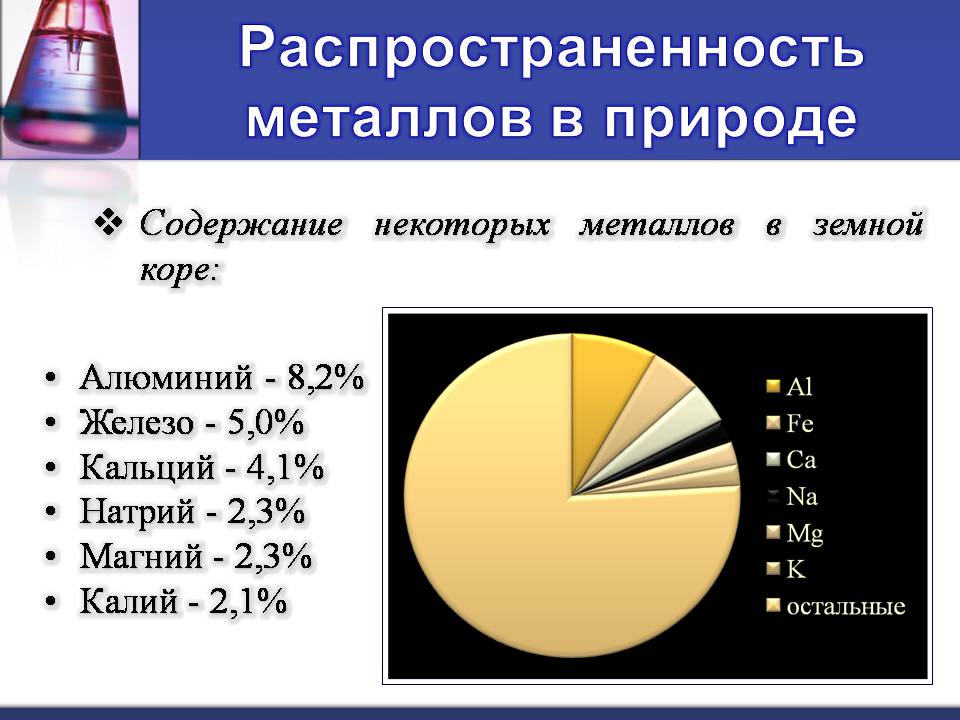
Распространенность металлов в природе
Содержание некоторых металлов в земной коре:
Алюминий - 8,2%
Железо - 5,0%
Кальций - 4,1%
Натрий - 2,3%
Магний - 2,3%
Калий - 2,1%
Содержание некоторых металлов в земной коре:
Алюминий - 8,2%
Железо - 5,0%
Кальций - 4,1%
Натрий - 2,3%
Магний - 2,3%
Калий - 2,1%
Слайд #3
Распространенность металлов в природе
Содержание некоторых металлов в морской воде:
Na+ 1,05%
Mg 2+ 0,12%
Содержание некоторых металлов в морской воде:
Na+ 1,05%
Mg 2+ 0,12%

Слайд #4
В природе металлы могут встречаться:
Только в свободном (самородном) виде (благородные металлы - золото, платина);
В самородном виде и в виде соединений (металлы малой активности – серебро, медь, ртуть, олово);
Только в виде соединений (металлы, стоящие в ряду напряжений до олова).
Только в свободном (самородном) виде (благородные металлы - золото, платина);
В самородном виде и в виде соединений (металлы малой активности – серебро, медь, ртуть, олово);
Только в виде соединений (металлы, стоящие в ряду напряжений до олова).

Слайд #5
Нахождение металлов в природе
Самородок золота
Самородок платины
Самородок серебра
Самородок меди
Ртуть
Олово
Самородок золота
Самородок платины
Самородок серебра
Самородок меди
Ртуть
Олово

Слайд #6
Способы получения металлов

Слайд #7
Руды

Слайд #8
Восстановители бывают:
неметаллические: кокс, оксид углерода (II), водород;
металлические: алюминий, магний, кальций и другие металлы.
неметаллические: кокс, оксид углерода (II), водород;
металлические: алюминий, магний, кальций и другие металлы.

Слайд #9
Восстановление:
из их оксидов углем или оксидом углерода (II)
ZnО + С = Zn + СО
водородом
Fе2О3 + ЗСО = 2Fе + ЗСО2
WO3 + 3H2 =W + 3H22O
СоО + Н2 = Со + Н2О
Руду, представляющую собой соль угольной кислоты, можно сразу восстанавливать при помощи угля:
ZnCO3 = ZnO + CO2
из их оксидов углем или оксидом углерода (II)
ZnО + С = Zn + СО
водородом
Fе2О3 + ЗСО = 2Fе + ЗСО2
WO3 + 3H2 =W + 3H22O
СоО + Н2 = Со + Н2О
Руду, представляющую собой соль угольной кислоты, можно сразу восстанавливать при помощи угля:
ZnCO3 = ZnO + CO2

Слайд #10
Получение меди из оксида с помощью водорода:
Cu +2O + H2 = Cu0 + H2O (водородотермия)
Получение железа из оксида с помощью алюминия.
Fe+32O3 +2Al = 2Fe0 + Al2O3 (алюмотермия)
Для получения железа в промышленности железную руду подвергают магнитному обогащению:
3Fe2 O3 + H2 = 2Fe3 O4 + H2O или 3Fe2O3 + CO = 2Fe3O4 + CO2 , а затем в вертикальной печи проходит процесс восстановления:
Fe3O4 + 4H2 = 3Fe + 4H2O
Fe3O4 + 4CO = 3Fe + 4CO2
Cu +2O + H2 = Cu0 + H2O (водородотермия)
Получение железа из оксида с помощью алюминия.
Fe+32O3 +2Al = 2Fe0 + Al2O3 (алюмотермия)
Для получения железа в промышленности железную руду подвергают магнитному обогащению:
3Fe2 O3 + H2 = 2Fe3 O4 + H2O или 3Fe2O3 + CO = 2Fe3O4 + CO2 , а затем в вертикальной печи проходит процесс восстановления:
Fe3O4 + 4H2 = 3Fe + 4H2O
Fe3O4 + 4CO = 3Fe + 4CO2

Слайд #11
Восстановление проводят химическими или электрохимическими способами. Химическое восстановление заключается во взаимодействии соединений металлов с углем, водородом или металлами-восстановителями. Например, при взаимодействии оксидов железа со специально обработанным углем (коксом) образуется чугун. С помощью водорода получают вольфрам, молибден, кобальт и другие металлы, например, по реакции:
WO3 + ЗН2 = W + ЗН2О
Многие металлы производят взаимодействием соединений металлов с другими металлами, например:
BeF2 + Mg = Be + MgF2
WO3 + ЗН2 = W + ЗН2О
Многие металлы производят взаимодействием соединений металлов с другими металлами, например:
BeF2 + Mg = Be + MgF2

Слайд #12
Кадмий
Хром
Титан
Цинк
Хром
Титан
Цинк

Слайд #13
Алюминий
Никель
Индий
Магний
Никель
Индий
Магний

Слайд #14
Промышленные способы получения металлов

Слайд #15
Пирометаллургия
Пирометаллургический способ - методы переработки руд, основанные на химических реакциях, происходящих при высоких температурах.
1 стадия: обжиг с целью перевода сульфидов в оксиды
ZnS + O2 → ZnO + SO2
2 стадия: восстановление металлов из оксидов
ZnO + CO → Zn + CO2
Соль → оксид
Соли кислородсодержащих кислот – термическое разложение:
CuCO3 = CuO + CO2
Соли бескислородных кислот- обжиг:
2ZnS + ЗО2 = 2ZnО + 2SО2
Восстановление углем или угарным газом:
CuO + C → Cu + CO
CuO + CO → Cu + CO2
Водородотермия:
Cr2O3 + H2 → Cr + H2O
Металлотермия:
Fe2O3 + Al → Fe + Al2O3
Пирометаллургический способ - методы переработки руд, основанные на химических реакциях, происходящих при высоких температурах.
1 стадия: обжиг с целью перевода сульфидов в оксиды
ZnS + O2 → ZnO + SO2
2 стадия: восстановление металлов из оксидов
ZnO + CO → Zn + CO2
Соль → оксид
Соли кислородсодержащих кислот – термическое разложение:
CuCO3 = CuO + CO2
Соли бескислородных кислот- обжиг:
2ZnS + ЗО2 = 2ZnО + 2SО2
Восстановление углем или угарным газом:
CuO + C → Cu + CO
CuO + CO → Cu + CO2
Водородотермия:
Cr2O3 + H2 → Cr + H2O
Металлотермия:
Fe2O3 + Al → Fe + Al2O3

Слайд #16
Гидрометаллургия
Гидрометаллургический способ – методы получения металлов, основанных на химических реакциях, происходящих в растворах:
1 стадия: перевод из руд в раствор
CuO + H2SO4 = CuSO4 + H2O
2 стадия: выделение из растворов другими металлами
CuSO4 + Fe = FeSO4 + Cu.
Гидрометаллургический способ – методы получения металлов, основанных на химических реакциях, происходящих в растворах:
1 стадия: перевод из руд в раствор
CuO + H2SO4 = CuSO4 + H2O
2 стадия: выделение из растворов другими металлами
CuSO4 + Fe = FeSO4 + Cu.

Слайд #17
Электрометаллургия
Электрометаллургический способ – то способы получения металлов с помощью электрического тока (электролиза). Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
Эл. ток
2Аl2О3 → 4Al + 3O2
(раствор в криолите)
2NaCl → 2Na + Cl2
MgBr2 → Mg + Br2
Термическое разложение соединений. Железо взаимодействует с оксидом углерода (II) при повышенном давлении и температуре 100-2000, образуя пентакарбонил:
Fe + 5CO = Fe (CO)5
Пентакарбонил железа-жидкость, которую можно легко отделить от примесей перегонкой. При температуре около 2500 карбонил разлагается, образуя порошок железа:
Fe (CO)5 = Fe + 5CO
Электрометаллургический способ – то способы получения металлов с помощью электрического тока (электролиза). Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
Эл. ток
2Аl2О3 → 4Al + 3O2
(раствор в криолите)
2NaCl → 2Na + Cl2
MgBr2 → Mg + Br2
Термическое разложение соединений. Железо взаимодействует с оксидом углерода (II) при повышенном давлении и температуре 100-2000, образуя пентакарбонил:
Fe + 5CO = Fe (CO)5
Пентакарбонил железа-жидкость, которую можно легко отделить от примесей перегонкой. При температуре около 2500 карбонил разлагается, образуя порошок железа:
Fe (CO)5 = Fe + 5CO

Слайд #18
Спасибо за внимание!!!
