- Головна
- Готові шкільні презентації
- Презентація на тему «Неметаллы»
Презентація на тему «Неметаллы»
218
Слайд #1
Неметаллы
Подготовила Кулешова Ксения
Ученица 10-А класса
Подготовила Кулешова Ксения
Ученица 10-А класса

Слайд #2
Неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы.

Слайд #3
Нахождение в природе
N
o
2
2
s
N
o
2
2
s

Слайд #4
Са5[PO4]3(F, Cl, ОН)АПАТИТ
Аметист
SiO
2
Аметист
SiO
2

Слайд #5
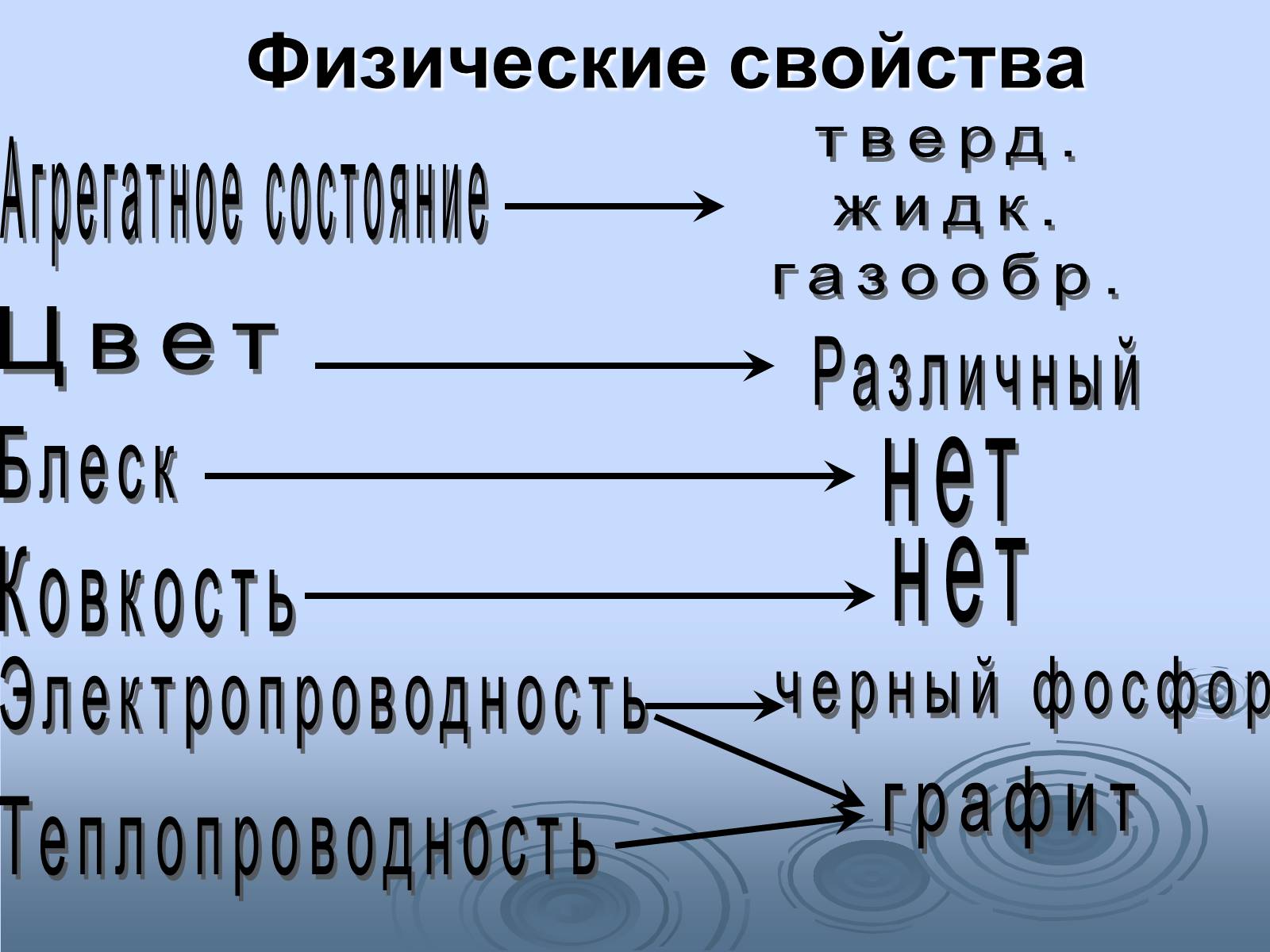
Физические свойства
Агрегатное состояние
тверд.
жидк.
газообр.
Цвет
Различный
Блеск
нет
нет
Ковкость
Электропроводность
черный фосфор
графит
Теплопроводность
Агрегатное состояние
тверд.
жидк.
газообр.
Цвет
Различный
Блеск
нет
нет
Ковкость
Электропроводность
черный фосфор
графит
Теплопроводность
Слайд #6
Взаимодействие с металлами:
2Na + Cl2 = 2NaCl,
Fe + S = FeS,
6Li + N2 = 2Li3N,
2Ca + O2 = 2CaO
В этих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.
2Na + Cl2 = 2NaCl,
Fe + S = FeS,
6Li + N2 = 2Li3N,
2Ca + O2 = 2CaO
В этих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.

Слайд #7
Взаимодействие с другими неметаллами:
взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения – ковалентные гидриды:
3H2 + N2 = 2NH3,
H2 + Br2 = 2HBr;
взаимодействуя с кислородом , все неметаллы, кроме фтора, проявляют восстановительные свойства:
S + O2 = SO2,
4P + 5O2 = 2P2O5;
взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения – ковалентные гидриды:
3H2 + N2 = 2NH3,
H2 + Br2 = 2HBr;
взаимодействуя с кислородом , все неметаллы, кроме фтора, проявляют восстановительные свойства:
S + O2 = SO2,
4P + 5O2 = 2P2O5;

Слайд #8
при взаимодействии с фтором фтор является окислителем, а кислород – восстановителем:
2F2 + O2 = 2OF2;
неметаллы взаимодействуют между собой, более электроотрицательный металл играет роль окислителя:
S + 3F2 = SF6,
C + 2Cl2 = CCl4.
2F2 + O2 = 2OF2;
неметаллы взаимодействуют между собой, более электроотрицательный металл играет роль окислителя:
S + 3F2 = SF6,
C + 2Cl2 = CCl4.

Слайд #9
Получение неметаллов
Способы получения неметаллов отличаются многообразием и специфичностью, общих подходов не существует. Рассмотрим основные способы получения некоторых неметаллов.
Получение галогенов. Самые активные галогены – фтор и хлор – получают электролизом. Фтор – электролизом расплава KHF2, хлор – электролизом расплава или раствора хлорида натрия.
Другие галогены можно также получить электролизом или вытеснением из их солей в растворе с помощью более активного галогена:
Cl2 + 2NaI = 2NaCl + I2.
Способы получения неметаллов отличаются многообразием и специфичностью, общих подходов не существует. Рассмотрим основные способы получения некоторых неметаллов.
Получение галогенов. Самые активные галогены – фтор и хлор – получают электролизом. Фтор – электролизом расплава KHF2, хлор – электролизом расплава или раствора хлорида натрия.
Другие галогены можно также получить электролизом или вытеснением из их солей в растворе с помощью более активного галогена:
Cl2 + 2NaI = 2NaCl + I2.

Слайд #10
Получение водорода. Основной промышленный способ получения водорода – конверсия метана (каталитический процесс):
CH4 + H2O = CO + 3H2.
Получение кремния. Кремний получают восстановлением коксом из кремнезема:
SiO2 + 2C = Si + 2CO.
Получение фосфора. Фосфор получают восстановлением из фосфата кальция, который входит в состав апатита и фосфорита:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P+5CO.
CH4 + H2O = CO + 3H2.
Получение кремния. Кремний получают восстановлением коксом из кремнезема:
SiO2 + 2C = Si + 2CO.
Получение фосфора. Фосфор получают восстановлением из фосфата кальция, который входит в состав апатита и фосфорита:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P+5CO.

Слайд #11
Кислород и азот получают фракционной перегонкой жидкого воздуха.
Сера и углерод встречаются в природе в самородном виде.
Селен и теллур получают из отходов производства серной кислоты, так как эти элементы встречаются в природе вместе с соединениями серы.
Мышьяк получают из мышьяковистого колчедана по сложной схеме превращений, включающей стадии получения оксида и восстановления из оксида углеродом.
Бор получают восстановлением оксида бора магнием.
Сера и углерод встречаются в природе в самородном виде.
Селен и теллур получают из отходов производства серной кислоты, так как эти элементы встречаются в природе вместе с соединениями серы.
Мышьяк получают из мышьяковистого колчедана по сложной схеме превращений, включающей стадии получения оксида и восстановления из оксида углеродом.
Бор получают восстановлением оксида бора магнием.

Слайд #12
Применение неметаллов
Водород используется в химической промышленности для синтеза аммиака, хлороводорода и метанола, применяется для гидрогенизации жиров.
Водород используется в химической промышленности для синтеза аммиака, хлороводорода и метанола, применяется для гидрогенизации жиров.
Бром и йод используют в синтезе полимерных материалов, для приготовления лекарственных препаратов и др.
Кислород применяется при сжигании топлива, при выплавке чугуна и стали, для сварки металлов, необходим для жизнедеятельности организмов
Водород используется в химической промышленности для синтеза аммиака, хлороводорода и метанола, применяется для гидрогенизации жиров.
Водород используется в химической промышленности для синтеза аммиака, хлороводорода и метанола, применяется для гидрогенизации жиров.
Бром и йод используют в синтезе полимерных материалов, для приготовления лекарственных препаратов и др.
Кислород применяется при сжигании топлива, при выплавке чугуна и стали, для сварки металлов, необходим для жизнедеятельности организмов

Слайд #13
Сера используется для производства серной кислоты, изготовления спичек, пороха, для борьбы с вредителями сельского хозяйства и лечения некоторых болезней, в производстве красителей, взрывчатых веществ, люминофоров.
Азот и фосфор применяются при производстве минеральных удобрений, азот применяется при синтезе аммиака, для создания инертной атмосферы в лампах, используется в медицине. Фосфор применяется при производстве фосфорной кислоты.
Азот и фосфор применяются при производстве минеральных удобрений, азот применяется при синтезе аммиака, для создания инертной атмосферы в лампах, используется в медицине. Фосфор применяется при производстве фосфорной кислоты.
