- Головна
- Готові шкільні презентації
- Презентація на тему «Хімічні властивості кисню»
Презентація на тему «Хімічні властивості кисню»
249
Слайд #1
Хімічні
властивості
кисню
властивості
кисню

Слайд #2
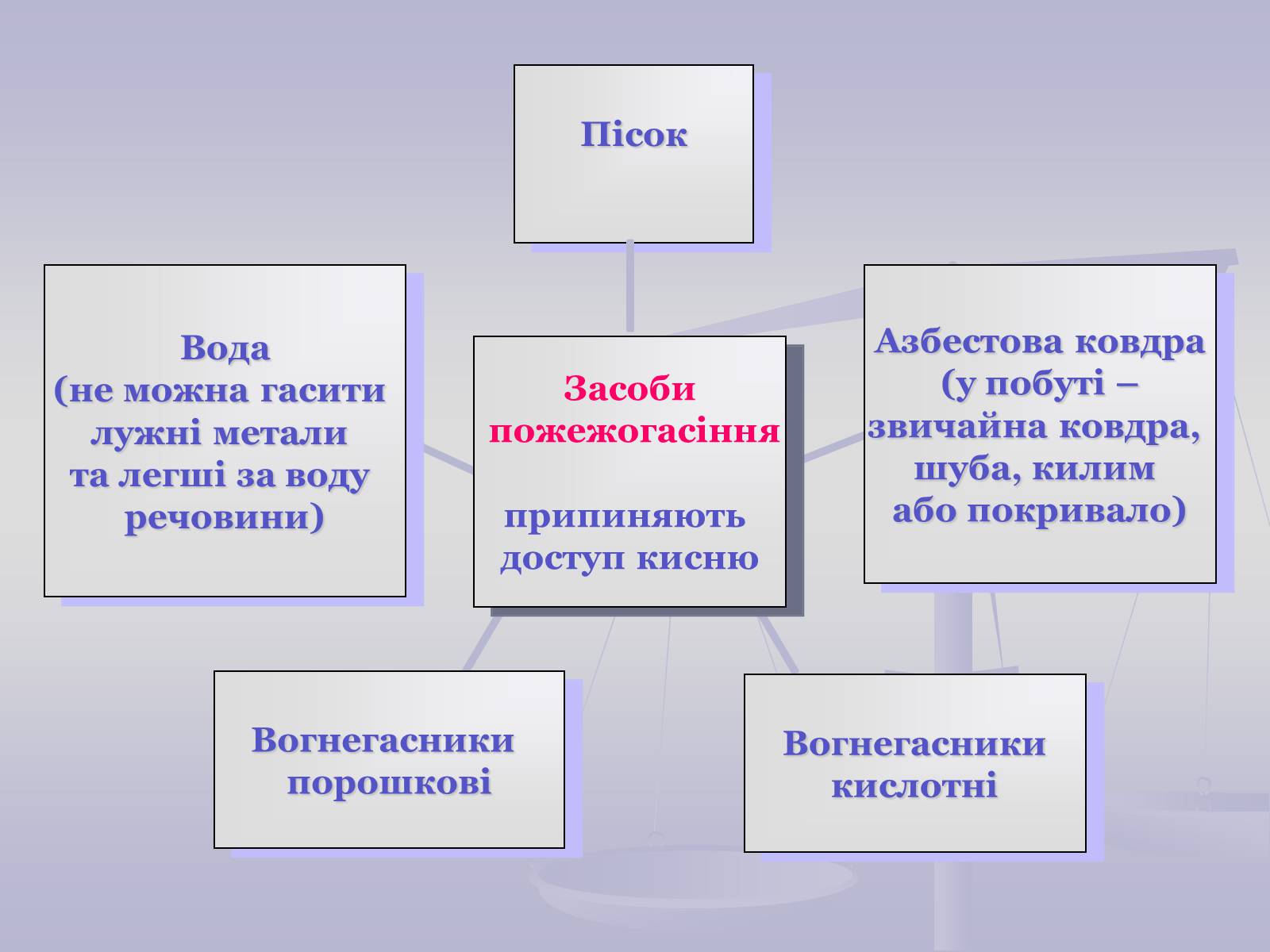
Мета уроку:
ознайомитись з хімічними властивостями кисню;
сформувати поняття про оксиди, окиснення, горіння;
з'ясувати умови виникнення та припинення горіння;
ознайомитись з заходами протипожежної безпеки.
ознайомитись з хімічними властивостями кисню;
сформувати поняття про оксиди, окиснення, горіння;
з'ясувати умови виникнення та припинення горіння;
ознайомитись з заходами протипожежної безпеки.

Слайд #3
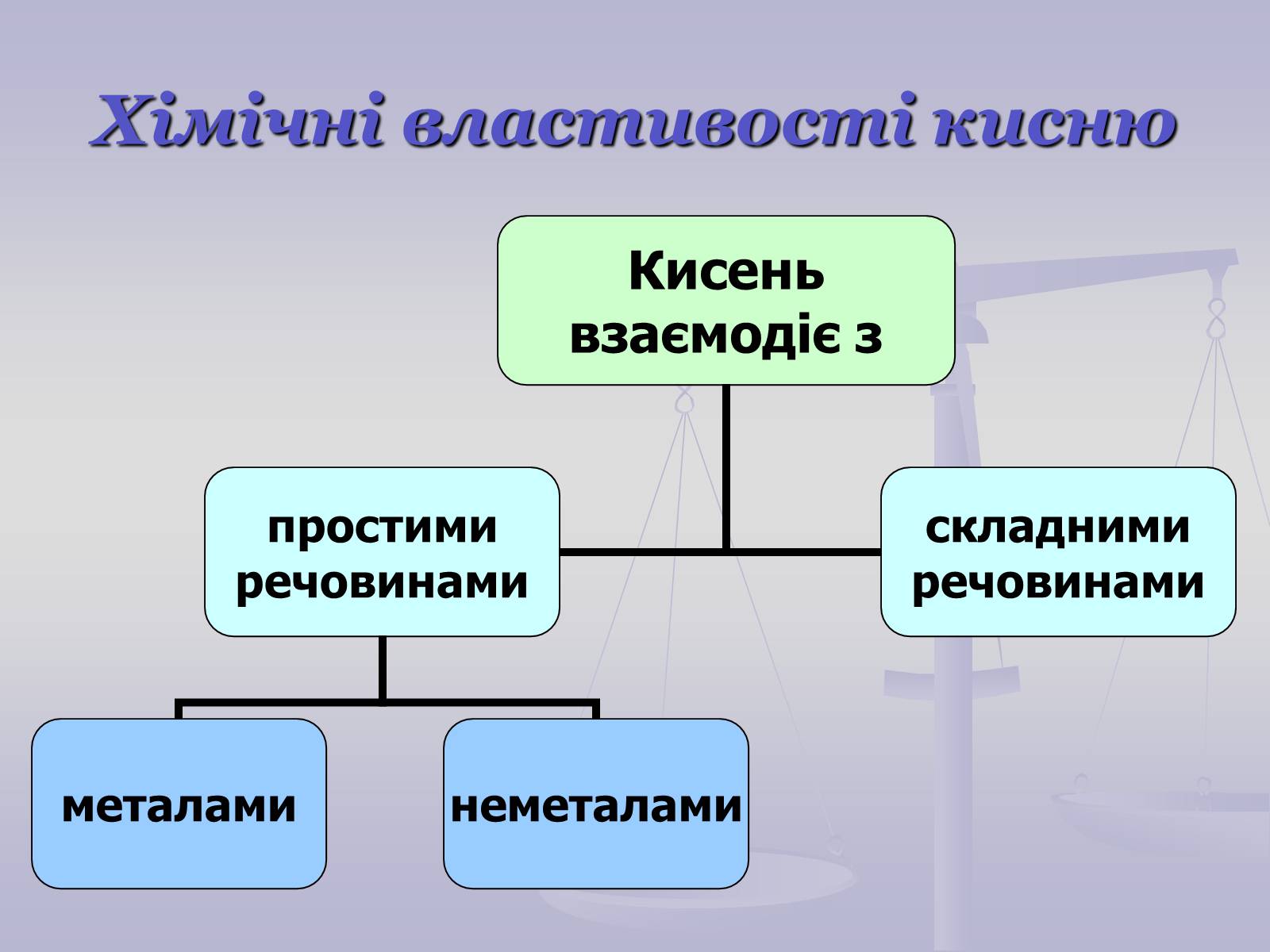
Хімічні властивості кисню
Слайд #4
Хімічні властивості кисню
Унаслідок взаємодії речовин із киснем утворюються бінарні сполуки, до складу яких входить Оксиген. Такі сполуки називають оксидами.
Взаємодія речовин з киснем належить до реакцій окиснення.
Горіння – це хімічна реакція, під час якої відбувається окиснення речовин з виділенням тепла і світла.
Унаслідок взаємодії речовин із киснем утворюються бінарні сполуки, до складу яких входить Оксиген. Такі сполуки називають оксидами.
Взаємодія речовин з киснем належить до реакцій окиснення.
Горіння – це хімічна реакція, під час якої відбувається окиснення речовин з виділенням тепла і світла.

Слайд #5
Горіння простих речовин в кисні

Слайд #6
Горіння неметалів
Взаємодія кисню з сіркою:
S + О2 → SO2
Взаємодія кисню з фосфором:
4P + 5О2 → 2P2O5
Завдяки утворенню густого білого диму Р2О5 цю реакцію використовують для створення димової завіси
Взаємодія кисню з сіркою:
S + О2 → SO2
Взаємодія кисню з фосфором:
4P + 5О2 → 2P2O5
Завдяки утворенню густого білого диму Р2О5 цю реакцію використовують для створення димової завіси

Слайд #7
Горіння металів
Взаємодія кисню з магнієм:
2Mg + О2 → 2MgO
Цю реакцію раніше використовували фотографи для створення спалаху.
Взаємодія кисню з залізом:
2Fe + О2 → 2FeO
Цю реакцію можна спостерігати на будівництвах під час різання та зварюванню металів.
Взаємодія кисню з магнієм:
2Mg + О2 → 2MgO
Цю реакцію раніше використовували фотографи для створення спалаху.
Взаємодія кисню з залізом:
2Fe + О2 → 2FeO
Цю реакцію можна спостерігати на будівництвах під час різання та зварюванню металів.

Слайд #8
Взаємодія кисню зі складними речовинами
Горіння складних речовин принципово не відрізняється від горіння простих речовин.
При горінні складних речовин утворюються оксиди всіх елементів, які входять до складу цієї речовини.
Горіння складних речовин принципово не відрізняється від горіння простих речовин.
При горінні складних речовин утворюються оксиди всіх елементів, які входять до складу цієї речовини.

Слайд #9
Горіння бензену в кисні

Слайд #10
Горіння складних речовин
Взаємодія кисню з бензеном С6Н6:
2C6H6 + 15О2 → 12CO2 + 6H2O
Взаємодія кисню з метаном СН4 (природним газом):
CH4 + 2О2 → CO2 + 2H2O
Взаємодія кисню зі спиртом С16Н34О :
C16H34O + 24О2 → 16CO2 + 17H2O
Взаємодія кисню з бензеном С6Н6:
2C6H6 + 15О2 → 12CO2 + 6H2O
Взаємодія кисню з метаном СН4 (природним газом):
CH4 + 2О2 → CO2 + 2H2O
Взаємодія кисню зі спиртом С16Н34О :
C16H34O + 24О2 → 16CO2 + 17H2O

Слайд #11
Горіння складних речовин
Взаємодія кисню з бензеном С6Н6:
2C6H6 + 15О2 → 12CO2 + 6H2O
Взаємодія кисню з метаном СН4 (природним газом):
CH4 + 2О2 → CO2 + 2H2O
Взаємодія кисню зі спиртом С16Н34О :
C16H34O + 24О2 → 16CO2 + 17H2O
Взаємодія кисню з бензеном С6Н6:
2C6H6 + 15О2 → 12CO2 + 6H2O
Взаємодія кисню з метаном СН4 (природним газом):
CH4 + 2О2 → CO2 + 2H2O
Взаємодія кисню зі спиртом С16Н34О :
C16H34O + 24О2 → 16CO2 + 17H2O
Слайд #12
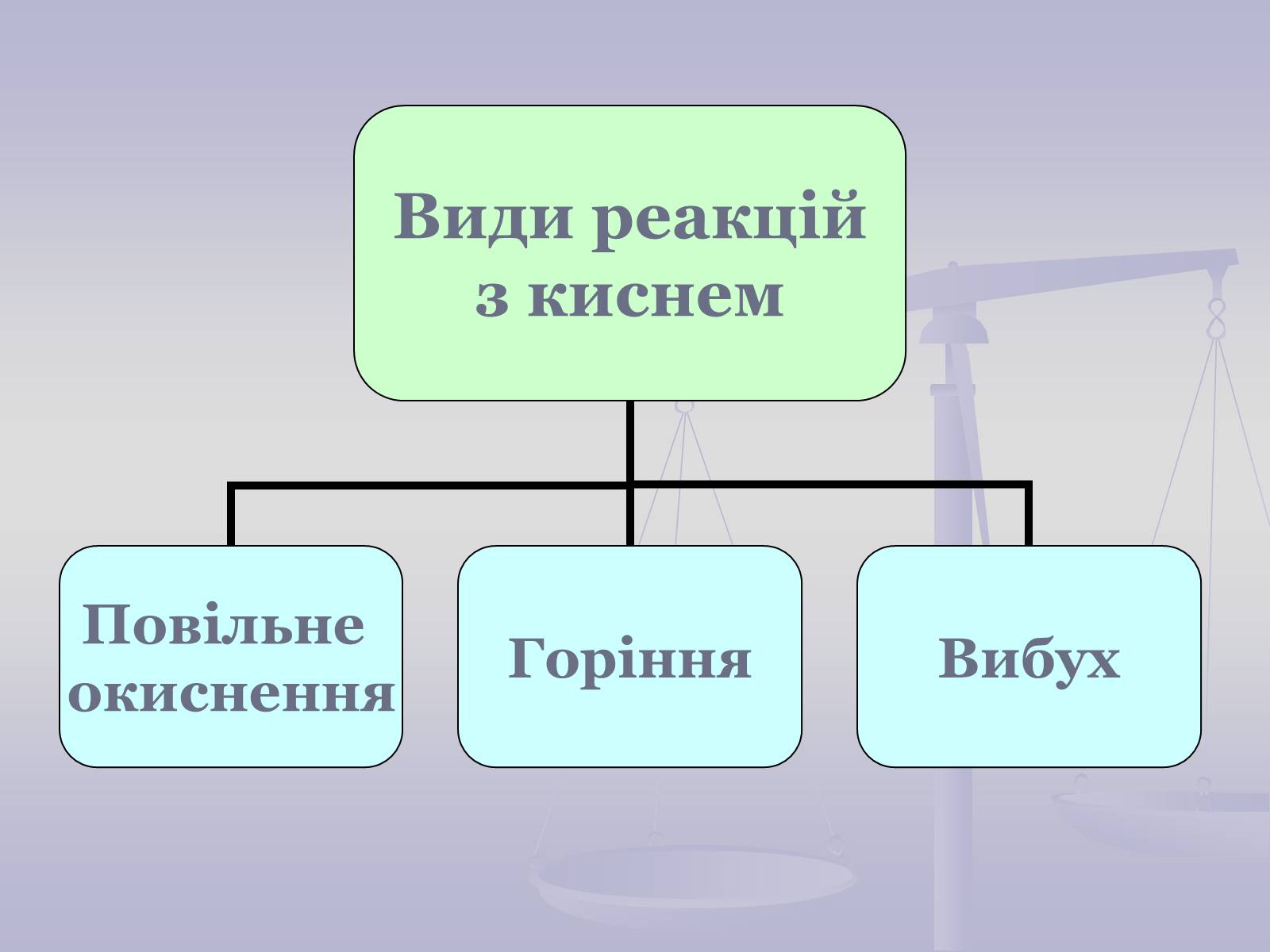
Повільне окиснення
Відбувається повільно.
Теплота виділяється поступово.
Не супроводжується полум'ям.
Приклади:
Залізні предмети з часом вкриваються іржею.
Скисання молока або сока.
Ваші приклади.
Відбувається повільно.
Теплота виділяється поступово.
Не супроводжується полум'ям.
Приклади:
Залізні предмети з часом вкриваються іржею.
Скисання молока або сока.
Ваші приклади.

Слайд #13
Вибух
Відбувається дуже швидко.
Енергія, що виділяється, призводить до руйнівних наслідків.
Супроводжується вибуховою хвилею та іноді короткочасним спалахом.
Приклади:
Суміш кисню з воднем (гримучий газ).
Суміші природного газу або вугільного пилу з повітрям.
Тирса, просочена рідким киснем (вибухівка).
Відбувається дуже швидко.
Енергія, що виділяється, призводить до руйнівних наслідків.
Супроводжується вибуховою хвилею та іноді короткочасним спалахом.
Приклади:
Суміш кисню з воднем (гримучий газ).
Суміші природного газу або вугільного пилу з повітрям.
Тирса, просочена рідким киснем (вибухівка).

Слайд #14
Горіння
Відбувається швидко.
Виділяється велика кількість теплоти.
Найчастіше супроводжується полум'ям.
Умови виникнення:
вільний доступ кисню;
досягнення температури займання;
наявність горючої речовини.
Відбувається швидко.
Виділяється велика кількість теплоти.
Найчастіше супроводжується полум'ям.
Умови виникнення:
вільний доступ кисню;
досягнення температури займання;
наявність горючої речовини.

Слайд #15