- Головна
- Готові шкільні презентації
- Презентація на тему «Будова атома» (варіант 2)
Презентація на тему «Будова атома» (варіант 2)
257
Слайд #1
Періодичний закон і система хімічних елементів Д.І.Менделєєва. Будова атома.

Слайд #2
Дмитро Іванович Менделєєв
Пригадайте:
Яку дату вважають “Днем народження” періодичного закону?
Що було взято вченим за основу при створенні періодичного закону?
Сформулюйте визначення періодичного закону.
Пригадайте:
Яку дату вважають “Днем народження” періодичного закону?
Що було взято вченим за основу при створенні періодичного закону?
Сформулюйте визначення періодичного закону.

Слайд #3
Дмитро Іванович Менделєєв
Пригадайте:
Яку дату вважають “Днем народження” періодичного закону?
Що було взято вченим за основу при створенні періодичного закону?
Сформулюйте визначення періодичного закону.
Пригадайте:
Яку дату вважають “Днем народження” періодичного закону?
Що було взято вченим за основу при створенні періодичного закону?
Сформулюйте визначення періодичного закону.
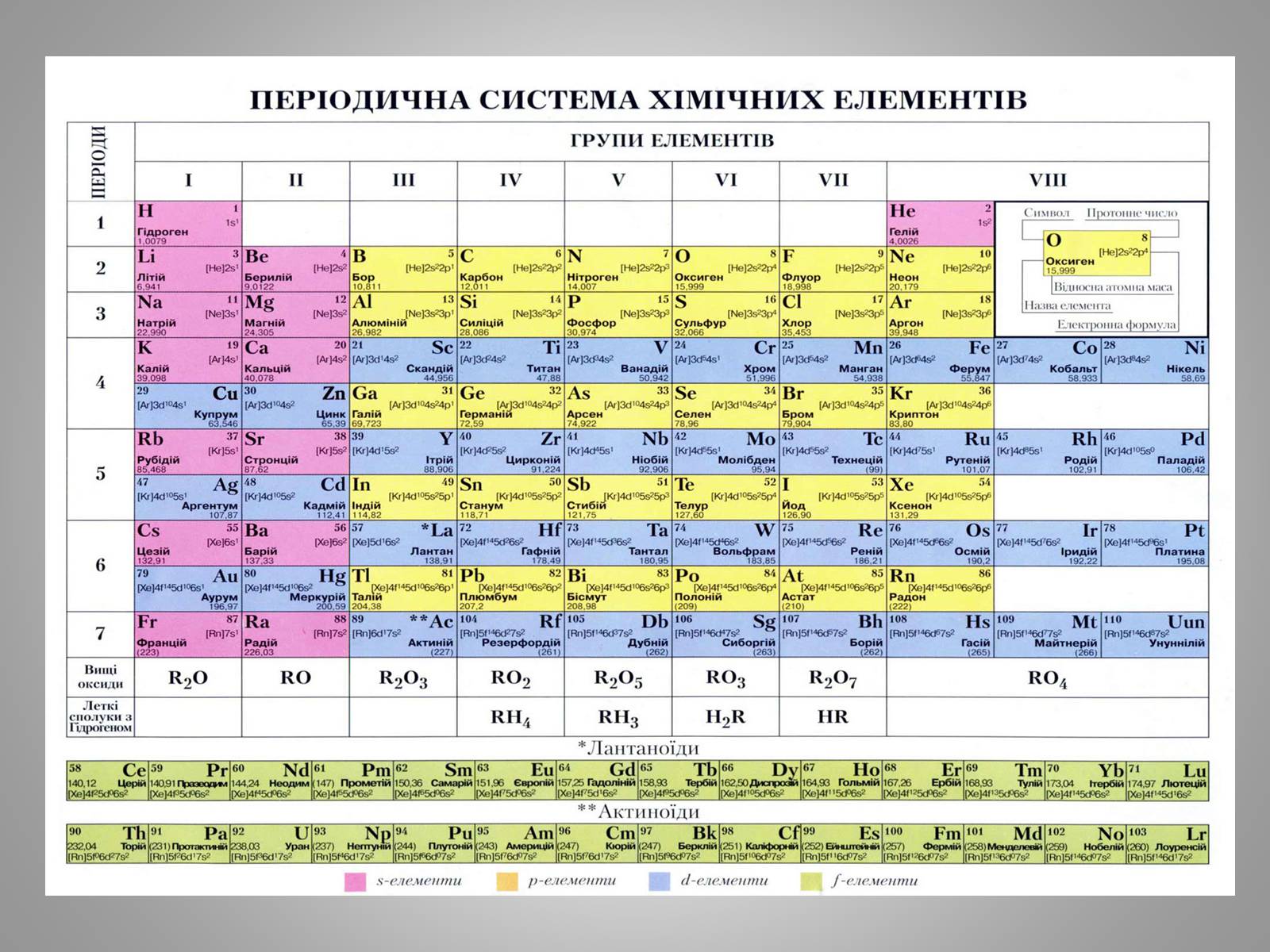
Слайд #4
Відповіді на запитання хімічного диктанту
Період
Малі періоди
Металічні властивості послаблюються
Групи
Головна і побічна підгрупи
Металічні властивості посилюються
За номером групи
Від 8 слід відняти номер групи
Період
Малі періоди
Металічні властивості послаблюються
Групи
Головна і побічна підгрупи
Металічні властивості посилюються
За номером групи
Від 8 слід відняти номер групи

Слайд #5
Будова атома.Склад атомних ядер.
Ви зможете:
зрозуміти зміст понять: радіоактивність, випромінювання, протонне та нуклонне числа;
дізнатися про: короткі відомості з історії розвитку наукових знань про будову атомів хімічних елементів, про фізичний зміст періодичного закону;
вдосконалити навички: визначати елементарний склад атомів хімічних елементів відповідно до їх положення в періодичній системі.
Ви зможете:
зрозуміти зміст понять: радіоактивність, випромінювання, протонне та нуклонне числа;
дізнатися про: короткі відомості з історії розвитку наукових знань про будову атомів хімічних елементів, про фізичний зміст періодичного закону;
вдосконалити навички: визначати елементарний склад атомів хімічних елементів відповідно до їх положення в періодичній системі.

Слайд #6
Атом
Пригадайте:
Яке визначення атома ви знаєте з уроків фізики, хімії, природознавства?
Яке походження має слово “атом”?
Що було відомо про будову атома за часи Д.М.Менделєєва?
Пригадайте:
Яке визначення атома ви знаєте з уроків фізики, хімії, природознавства?
Яке походження має слово “атом”?
Що було відомо про будову атома за часи Д.М.Менделєєва?

Слайд #7
Антуан Анрі Беккерель
У 1896 році під час одного зі своїх чисельних дослідів французький фізик Антуан Беккерель загорнув кристали сульфата ураніл-калію K2(UO2)(SO4)2 в чорний світлонепроникаючий папір і поклав на фотоплівку. Після проявки на ній з'явилися силуети кристалів.
Так була відкрита здатність сполук урану випромінювати іонізуючі промені, які засвітлюють в темряві фотоплівку та спричиняють світіння речовин в темряві.
У 1896 році під час одного зі своїх чисельних дослідів французький фізик Антуан Беккерель загорнув кристали сульфата ураніл-калію K2(UO2)(SO4)2 в чорний світлонепроникаючий папір і поклав на фотоплівку. Після проявки на ній з'явилися силуети кристалів.
Так була відкрита здатність сполук урану випромінювати іонізуючі промені, які засвітлюють в темряві фотоплівку та спричиняють світіння речовин в темряві.

Слайд #8
П'єр Кюрі і Марія Склодовська-Кюрі
Фанатично віддані своїй справі вчені, не маючи навіть лабораторії, працюючи в невеличкому сараї на вулиці Ломон в Парижі з 1898 по 1902 роки переробили понад 8 тонн уранової руди, щоб добути одну соту грама нової речовини — Радію.
У 1903 році за відкриття радіоактивності подружжя отримало Нобелівську премію з фізики.
Пізніше був відкритий новий елемент названий на честь батьківщини Марії - Полонієм.
У 1911 році, вже після смерті чоловіка, Марія Кюрі здобула Нобелівську премію вдруге – за відкриття нових хімічних елементів: Полонію та Радію.
Фанатично віддані своїй справі вчені, не маючи навіть лабораторії, працюючи в невеличкому сараї на вулиці Ломон в Парижі з 1898 по 1902 роки переробили понад 8 тонн уранової руди, щоб добути одну соту грама нової речовини — Радію.
У 1903 році за відкриття радіоактивності подружжя отримало Нобелівську премію з фізики.
Пізніше був відкритий новий елемент названий на честь батьківщини Марії - Полонієм.
У 1911 році, вже після смерті чоловіка, Марія Кюрі здобула Нобелівську премію вдруге – за відкриття нових хімічних елементів: Полонію та Радію.

Слайд #9
Джозеф Джон Томсон
Американський вчений Джозеф Томсон у 1906 році також отримав Нобелівську премію за відкриття електрона, існування якого передбачив ще у 1897 році. Але модель атома, запропонована вченим у 1903 році, в якій «електрони, наче родзинки в кексі, рівномірно розподіляються в позитивно зарядженій субстанції», не була досконалою.
Американський вчений Джозеф Томсон у 1906 році також отримав Нобелівську премію за відкриття електрона, існування якого передбачив ще у 1897 році. Але модель атома, запропонована вченим у 1903 році, в якій «електрони, наче родзинки в кексі, рівномірно розподіляються в позитивно зарядженій субстанції», не була досконалою.

Слайд #10
Ернест Резерфорд
Ернест Резерфорд вважається найбільшим фізиком-експериментатором двадцятого сторіччя. Він є людиною, яка поклала початок ядерній фізиці. Крім свого величезного теоретичного значення, його відкриття отримали широкий спектр застосування, включаючи, ядерну зброю, атомні електростанції, радіоактивні обчислення і дослідження радіації. Вплив праць Резерфорда на світ величезний. Воно продовжує рости і, схоже, ще збільшиться в майбутньому. У 1908 р. ученого нагородили Нобелівською премією за дослідження різних видів радіоактивності.
Ернест Резерфорд вважається найбільшим фізиком-експериментатором двадцятого сторіччя. Він є людиною, яка поклала початок ядерній фізиці. Крім свого величезного теоретичного значення, його відкриття отримали широкий спектр застосування, включаючи, ядерну зброю, атомні електростанції, радіоактивні обчислення і дослідження радіації. Вплив праць Резерфорда на світ величезний. Воно продовжує рости і, схоже, ще збільшиться в майбутньому. У 1908 р. ученого нагородили Нобелівською премією за дослідження різних видів радіоактивності.

Слайд #11
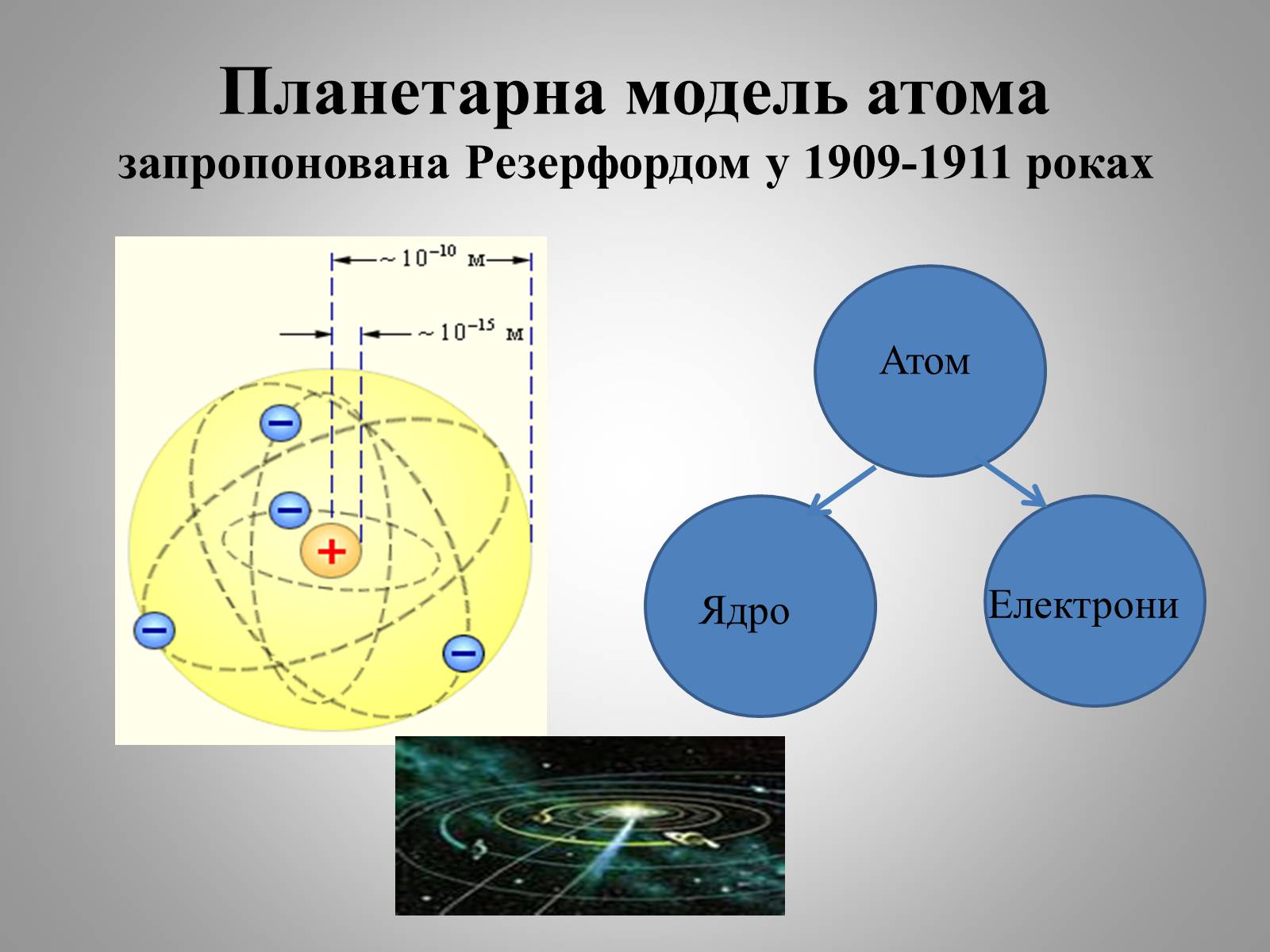
Планетарна модель атома запропонована Резерфордом у 1909-1911 роках
Атом
Ядро
Електрони
Атом
Ядро
Електрони
Слайд #12
Будова атомних ядер
У 1920 році Резерфорд ввів поняття про позитивно заряджену частинку у складі ядра атома - протон
У 1932 році Джеймс Чедвік виявив в ядрі атома нейтральну частинку - нейтрон
У 1920 році Резерфорд ввів поняття про позитивно заряджену частинку у складі ядра атома - протон
У 1932 році Джеймс Чедвік виявив в ядрі атома нейтральну частинку - нейтрон

Слайд #13
Генрі Мозлі
У 1910-1914 працював в лабораторії Е. Резерфорда в Манчестерському університеті, в 1914 р. повернувся до Оксфордського університету.
У 1913 в серії блискучих експериментів встановив залежність між частотою спектральних ліній характеристичного рентгенівського випромінювання і атомним номером випромінюючого елемента. Це фундаментальне відкриття мало величезне значення для встановлення фізичного сенсу періодичної системи елементів і атомного номера, і для підтвердження правильності концепції планетарного атома.
У 1910-1914 працював в лабораторії Е. Резерфорда в Манчестерському університеті, в 1914 р. повернувся до Оксфордського університету.
У 1913 в серії блискучих експериментів встановив залежність між частотою спектральних ліній характеристичного рентгенівського випромінювання і атомним номером випромінюючого елемента. Це фундаментальне відкриття мало величезне значення для встановлення фізичного сенсу періодичної системи елементів і атомного номера, і для підтвердження правильності концепції планетарного атома.

Слайд #14
Алгоритм визначення елементарного складу атомів
Відносна атомна маса хімічного елемента – нуклонне число
(масове число)
Порядковий номер хімічного елемента – протонне число
Заряд ядра атома співпадає з порядковим номером хімічного елемента (протонним числом) і обумовлений числом протонів
Число електронів = числу протонів, оскільки атом – електронейтральна частинка
Щоб обчислити число нейтронів, слід відняти від нуклонного числа кількість протонів
Відносна атомна маса хімічного елемента – нуклонне число
(масове число)
Порядковий номер хімічного елемента – протонне число
Заряд ядра атома співпадає з порядковим номером хімічного елемента (протонним числом) і обумовлений числом протонів
Число електронів = числу протонів, оскільки атом – електронейтральна частинка
Щоб обчислити число нейтронів, слід відняти від нуклонного числа кількість протонів

Слайд #15
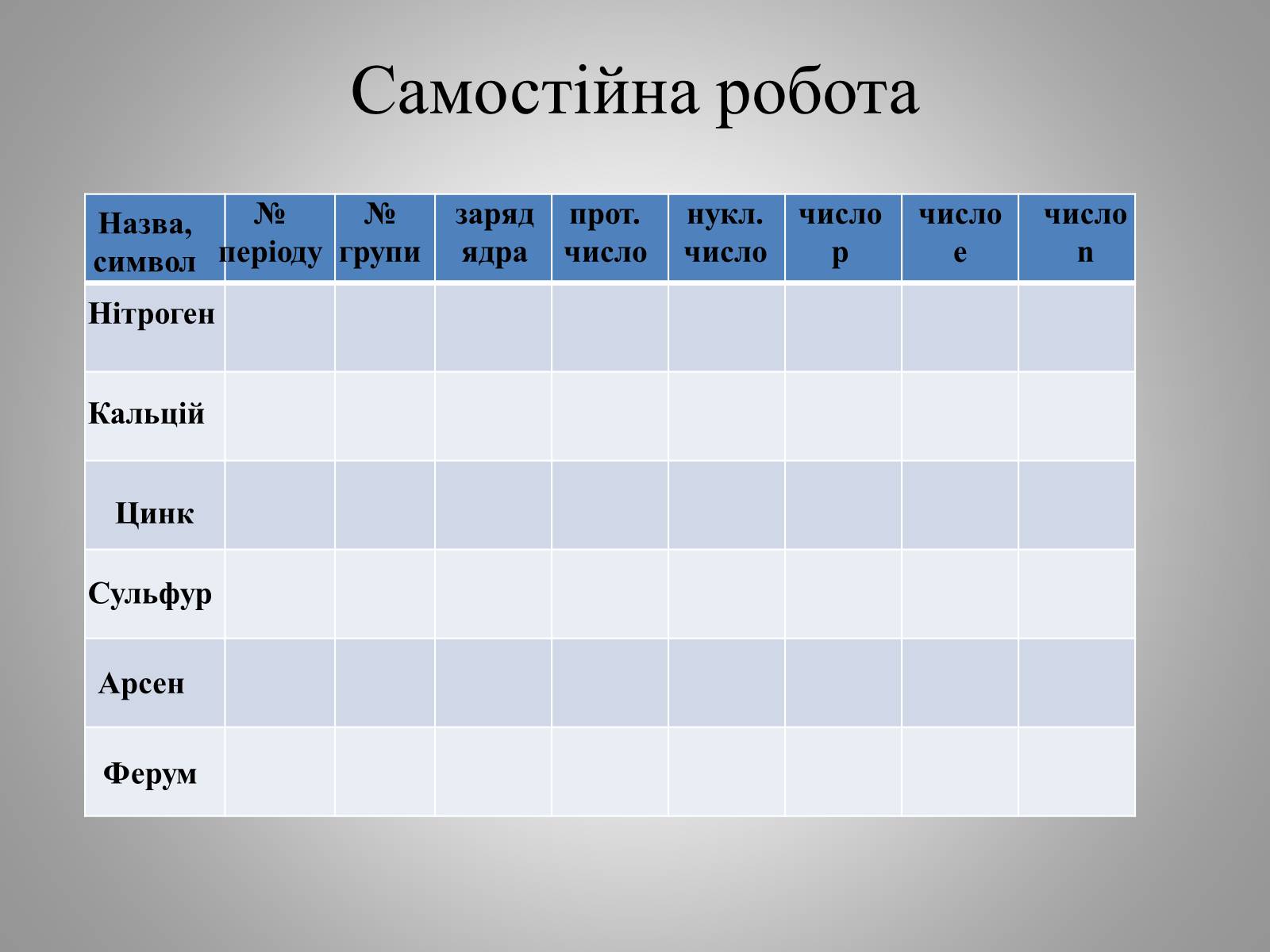
Самостійна робота
Назва, символ
№ періоду
№ групи
заряд ядра
нукл. число
число p
число e
число n
прот. число
Нітроген
Кальцій
Цинк
Сульфур
Арсен
Ферум
Назва, символ
№ періоду
№ групи
заряд ядра
нукл. число
число p
число e
число n
прот. число
Нітроген
Кальцій
Цинк
Сульфур
Арсен
Ферум
Слайд #16