- Головна
- Готові шкільні презентації
- Презентація на тему «Неметаллы, особенности строения»
Презентація на тему «Неметаллы, особенности строения»
271
Слайд #1
Неметаллы, особенности строения
Подготовила
Ученица 11-Б класса
Кинебас Наталья
Подготовила
Ученица 11-Б класса
Кинебас Наталья

Слайд #2
Ответьте на вопросы:
Какой химический элемент входит в состав любого органического вещества?
УГЛЕРОД
Какой химический элемент входит в состав любого органического вещества?
УГЛЕРОД

Слайд #3
Элемент, в переводе с греческого «несущий свет»?
ФОСФОР
ФОСФОР

Слайд #4
Какие 2 элемента наиболее распространены в космосе?
ВОДОРОД И ГЕЛИЙ
ВОДОРОД И ГЕЛИЙ

Слайд #5
Вещество, поддерживающее горение и дыхание?
КИСЛОРОД
КИСЛОРОД

Слайд #6
Самый легкий газ?
ВОДОРОД
ВОДОРОД

Слайд #7
Артур Конан Дойль
«СОБАКА БАСКЕРВИЛЕЙ»
Найдите химическую ошибку:
«СОБАКА БАСКЕРВИЛЕЙ»
Найдите химическую ошибку:

Слайд #8
Шерлок Холмс: «Фосфор! Странная смесь…Совершенно без запаха. Состав преступления теперь налицо…»

Слайд #9
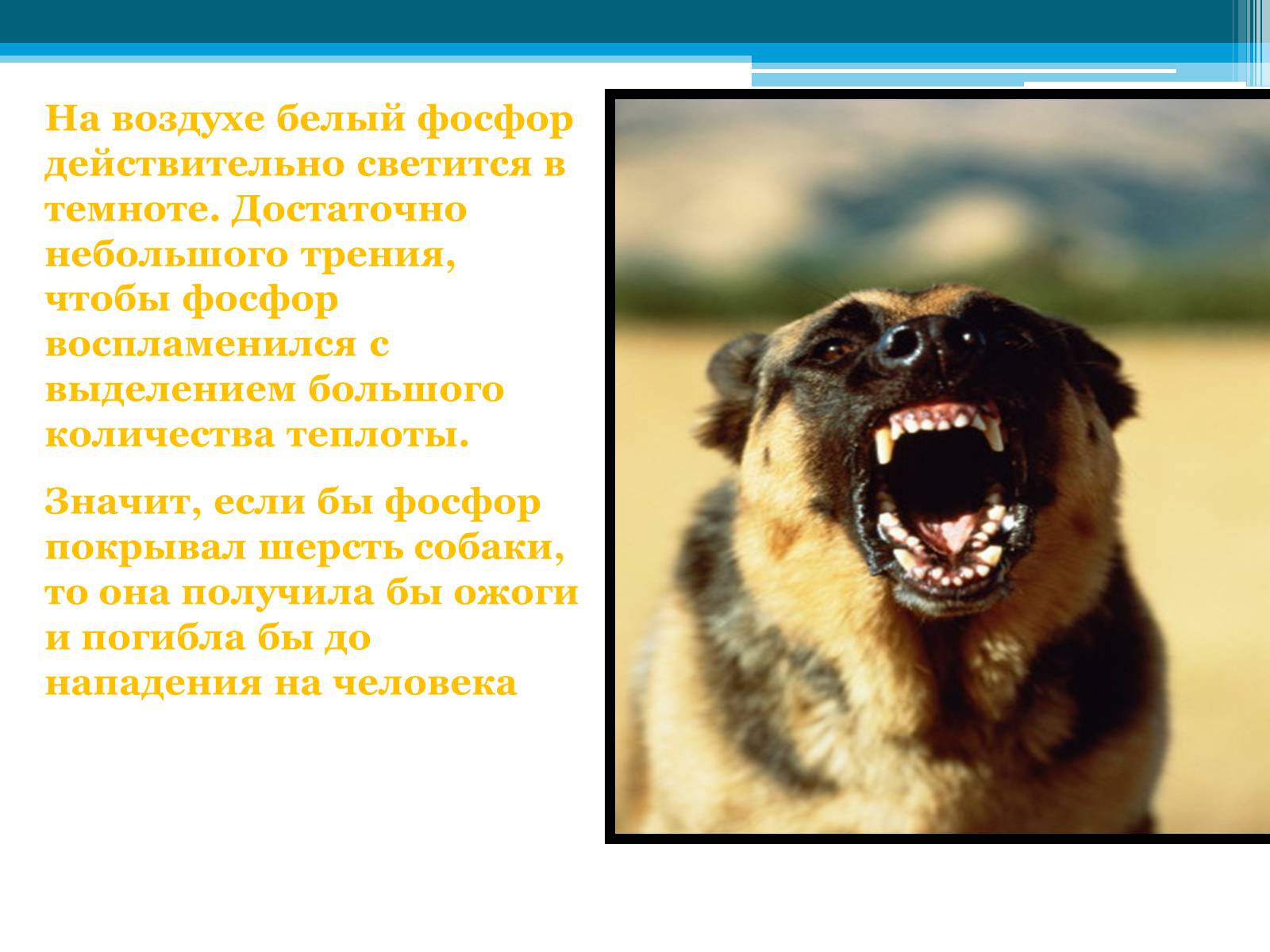
На воздухе белый фосфор действительно светится в темноте. Достаточно небольшого трения, чтобы фосфор воспламенился с выделением большого количества теплоты.
Значит, если бы фосфор покрывал шерсть собаки, то она получила бы ожоги и погибла бы до нападения на человека
Значит, если бы фосфор покрывал шерсть собаки, то она получила бы ожоги и погибла бы до нападения на человека
Слайд #10
Что объединяет все элементы из данного ряда?
Н, В, С, О, Р, F, S, N, He, Si
Н, В, С, О, Р, F, S, N, He, Si

Слайд #11
Что объединяет все показанные слайды?

Слайд #12
Что такое неметаллы?

Слайд #13
Используя опыт повседневной жизни, школьные знания приведите примеры, связанные с понятием неметаллов.

Слайд #14
Что вы знаете о неметаллах?
Запишите в тетрадях вопросы, которые вы хотите узнать о неметаллах, используя:
А) «тонкие» вопросы (где, кто, что, когда, как);
Б) «толстые» вопросы (зачем , почему)
Запишите в тетрадях вопросы, которые вы хотите узнать о неметаллах, используя:
А) «тонкие» вопросы (где, кто, что, когда, как);
Б) «толстые» вопросы (зачем , почему)

Слайд #15
У атомов неметаллов внешняя электронная оболочка содержит много ( от 4 до 7) электронов( исключение атом гелия, у которого 2 электрона)

Слайд #16
И стремится к завершению либо путем принятия недостающих электронов (тогда неметалл - окислитель) , либо путем отдачи электронов ( тогда неметалл - восстановитель).

Слайд #17
Если на внешней электронной оболочке 8 электронов это инертный газ.

Слайд #18
У атомов элементов-неметаллов в периоде с увеличением порядкового номера
заряд ядра увеличивается;
радиусы атомов уменьшаются;
число электронов на внешнем слое увеличивается;
число валентных электронов увеличивается;
электроотрицательность увеличивается;
окислительные (неметаллические) свойства усиливаются (кроме элементов VIIIA группы).
заряд ядра увеличивается;
радиусы атомов уменьшаются;
число электронов на внешнем слое увеличивается;
число валентных электронов увеличивается;
электроотрицательность увеличивается;
окислительные (неметаллические) свойства усиливаются (кроме элементов VIIIA группы).

Слайд #19
У атомов элементов-неметаллов в подгруппе (в длиннопериодной таблице - в группе) с увеличением порядкового номера
заряд ядра увеличивается;
радиус атома увеличивается;
электроотрицательность уменьшается;
число валентных электронов не изменяется;
число внешних электронов не изменяется (за исключением водорода и гелия);
окислительные (неметаллические) свойства ослабевают (кроме элементов VIIIA группы).
заряд ядра увеличивается;
радиус атома увеличивается;
электроотрицательность уменьшается;
число валентных электронов не изменяется;
число внешних электронов не изменяется (за исключением водорода и гелия);
окислительные (неметаллические) свойства ослабевают (кроме элементов VIIIA группы).

Слайд #20
Простые вещества.
Большинство неметаллов - простые вещества, в которых атомы связаны ковалентными связями; в благородных газах химических связей нет. Среди неметаллов есть как молекулярные, так и немолекулярные вещества. Все это приводит к тому, что физических свойств, характерных для всех неметаллов, нет.
Большинство неметаллов - простые вещества, в которых атомы связаны ковалентными связями; в благородных газах химических связей нет. Среди неметаллов есть как молекулярные, так и немолекулярные вещества. Все это приводит к тому, что физических свойств, характерных для всех неметаллов, нет.

Слайд #21
Неметаллы в природе
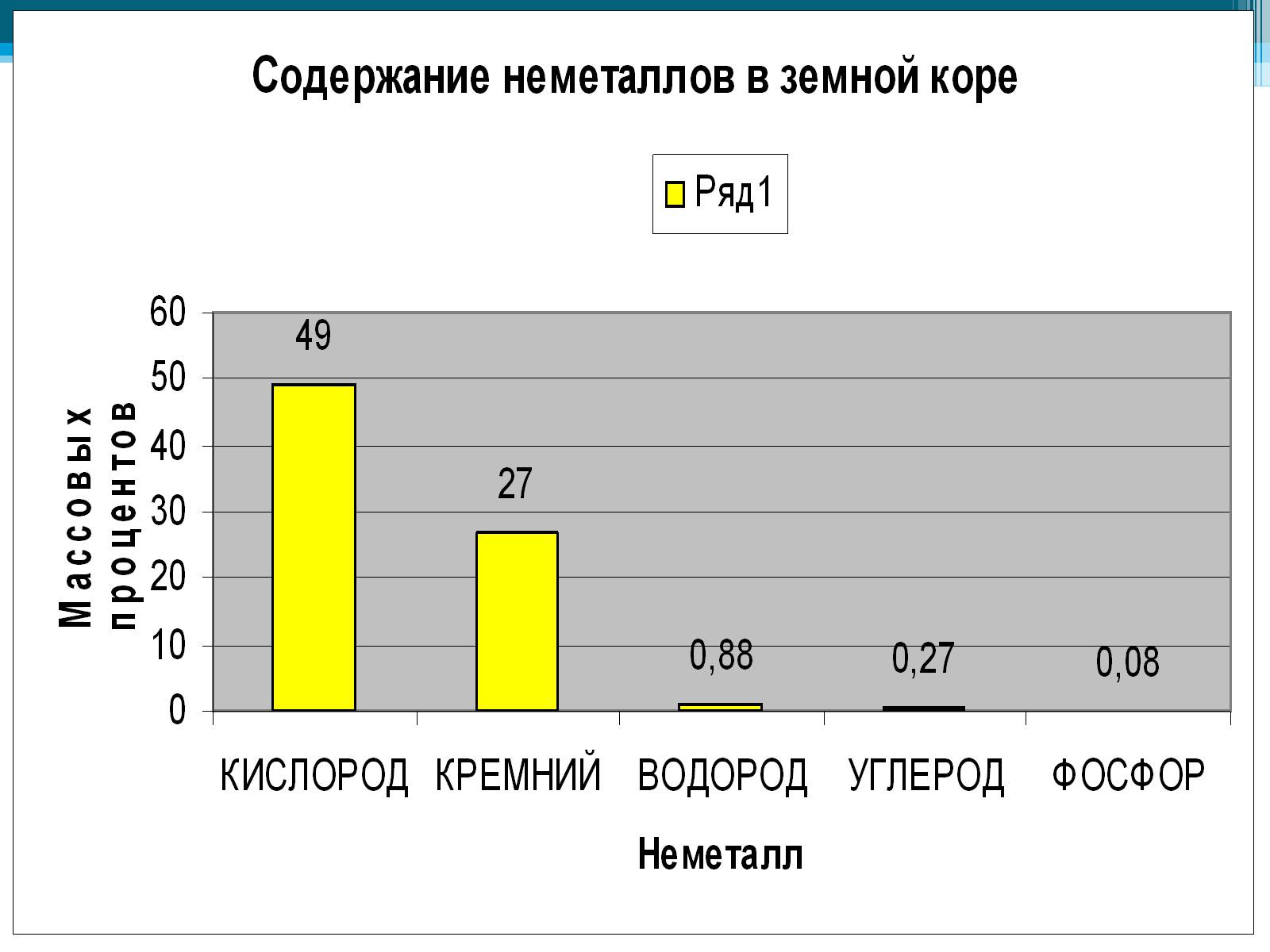
В природе встречаются самородные неметаллы N2 и O2 (в воздухе), сера (в земной коре), но чаще неметаллы в природе находятся в химически связанном виде. В первую очередь это вода и растворённые в ней соли, затем минералы и горные породы (например различные силикаты, алюмосиликаты, фосфаты, бораты, сульфаты и карбонаты).
По распространенности в земной коре неметаллы занимают самые различные места: от трех самых распространенных элементов (O, Si, H) до весьма редких (As, Se, I, Te).
В природе встречаются самородные неметаллы N2 и O2 (в воздухе), сера (в земной коре), но чаще неметаллы в природе находятся в химически связанном виде. В первую очередь это вода и растворённые в ней соли, затем минералы и горные породы (например различные силикаты, алюмосиликаты, фосфаты, бораты, сульфаты и карбонаты).
По распространенности в земной коре неметаллы занимают самые различные места: от трех самых распространенных элементов (O, Si, H) до весьма редких (As, Se, I, Te).

Слайд #22
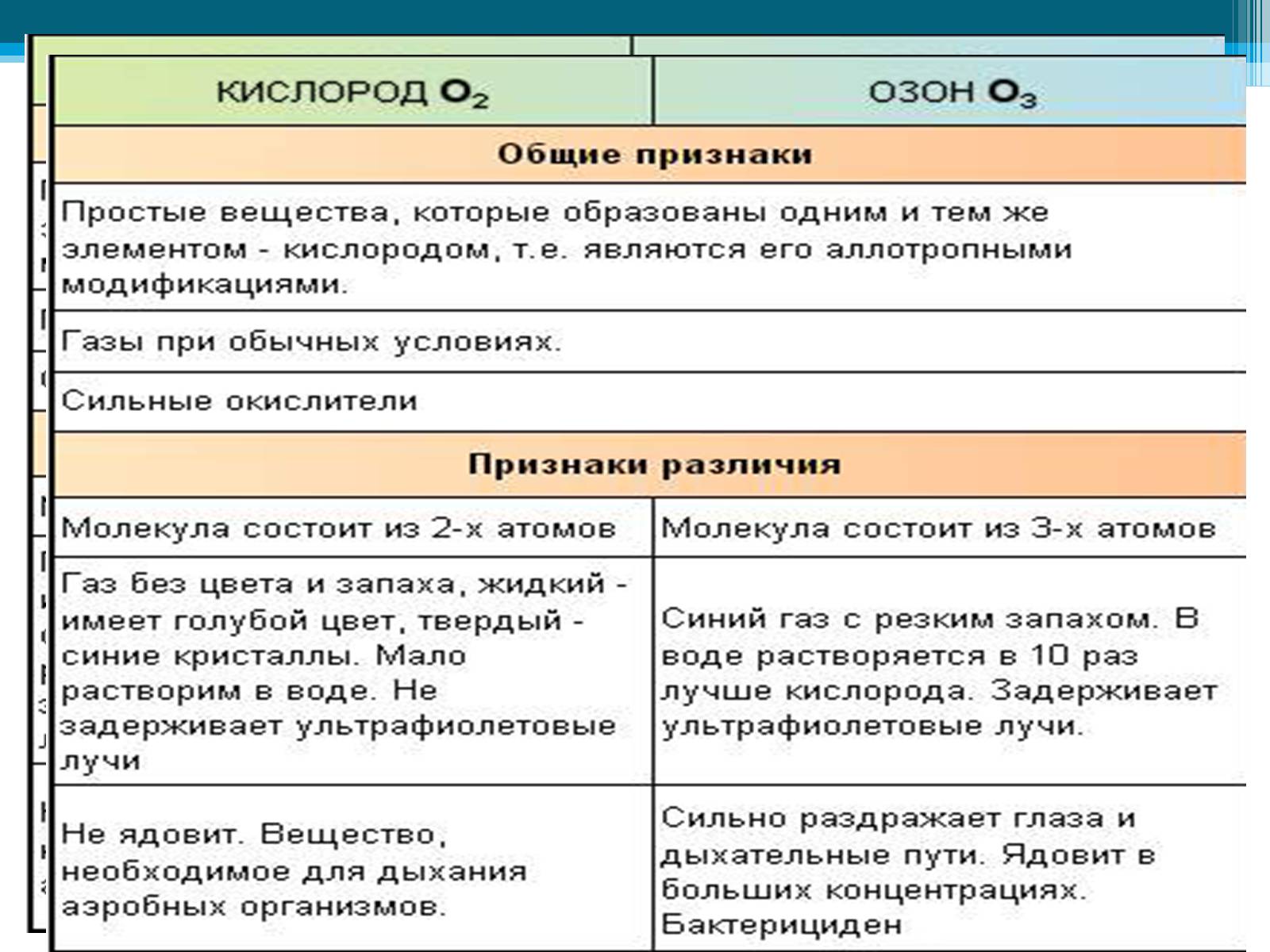
Кислород — газ без цвета, а озон имеет бледно-фиолетовый цвет. Озон более бактерициден (лат. ицдао — «убивать»), чем кислород. Поэтому озон применяется для обеззараживания питье вой воды. Озон способен удерживать ультрафиолетовые лучи солнечного спектра, которые губительны для всего живого на Земле, и потому озоновый экран, который располагается в атмосфер на высот» 20—35 км, защищает жизнь на нашей планете
Кислород
Кислород

Слайд #23
Кислород — газ без цвета, а озон имеет бледно-фиолетовый цвет. Озон более бактерициден (лат. ицдао — «убивать»), чем кислород. Поэтому озон применяется для обеззараживания питье вой воды. Озон способен удерживать ультрафиолетовые лучи солнечного спектра, которые губительны для всего живого на Земле, и потому озоновый экран, который располагается в атмосфер на высот» 20—35 км, защищает жизнь на нашей планете
Кислород
Кислород
Слайд #24
Красный фосфор
Сера
Алмаз
Кислород
Сера
Алмаз
Кислород

Слайд #25
Фосфор в природе
Апатит (содержит фосфат кальция)
Апатит (содержит фосфат кальция)

Слайд #26
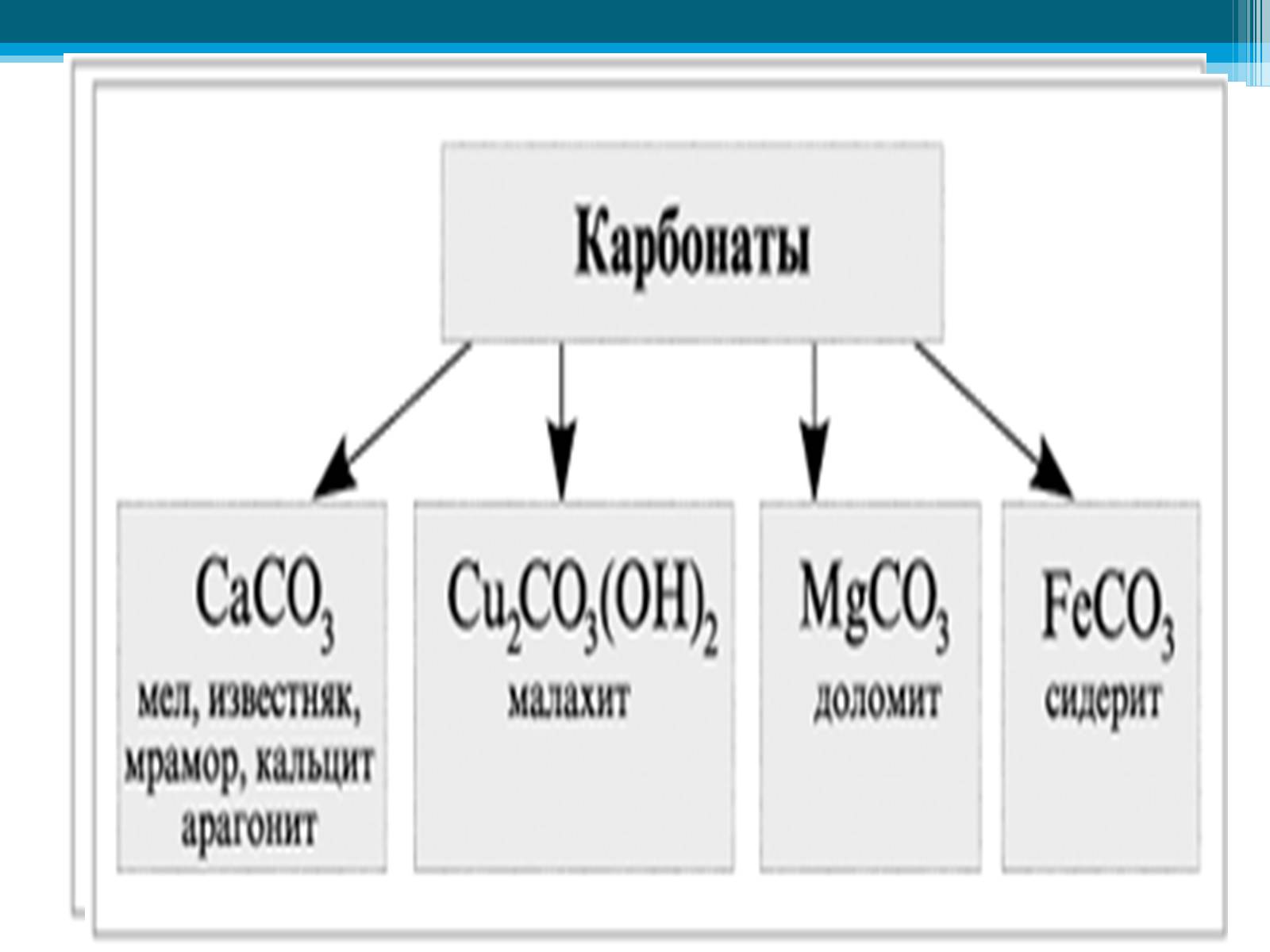
Карбонаты

Слайд #27
Карбонаты
Слайд #28
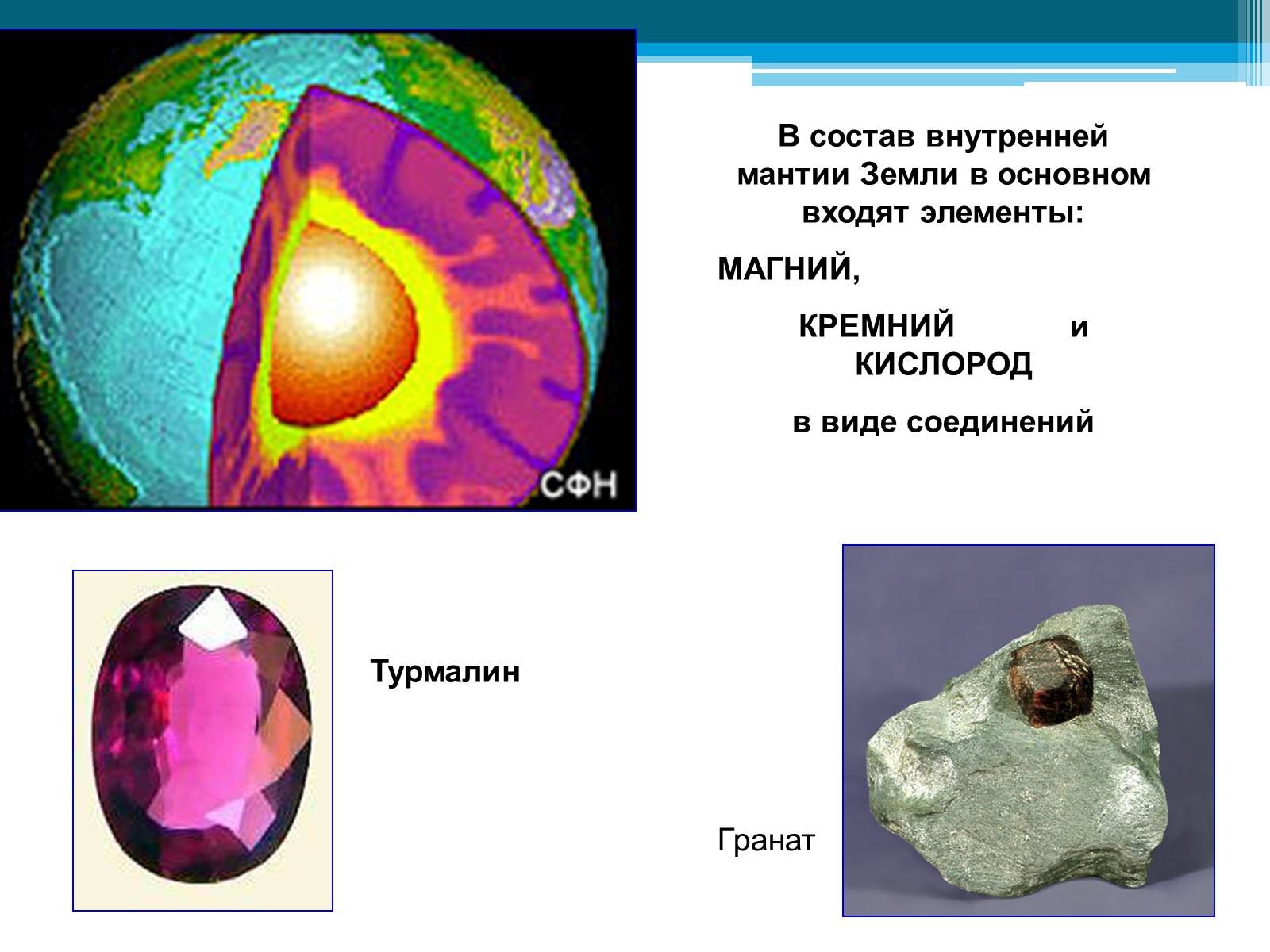
В состав внутренней мантии Земли в основном входят элементы:
МАГНИЙ,
КРЕМНИЙ и КИСЛОРОД
в виде соединений
Турмалин
Гранат
МАГНИЙ,
КРЕМНИЙ и КИСЛОРОД
в виде соединений
Турмалин
Гранат
Слайд #29
Галогены в природе
Фтор-F2 Флюорит -CaF2
Бром-Br2
в аналогичных соединениях, вместе с хлором
Хлор-Cl2 каменная соль- NaCl
сильвинит –NaCl*KCl
Иод-J2
морская вода , водоросли, буровые воды
Кристаллы хлорида натрия – минерал галит
Фтор-F2 Флюорит -CaF2
Бром-Br2
в аналогичных соединениях, вместе с хлором
Хлор-Cl2 каменная соль- NaCl
сильвинит –NaCl*KCl
Иод-J2
морская вода , водоросли, буровые воды
Кристаллы хлорида натрия – минерал галит

Слайд #30
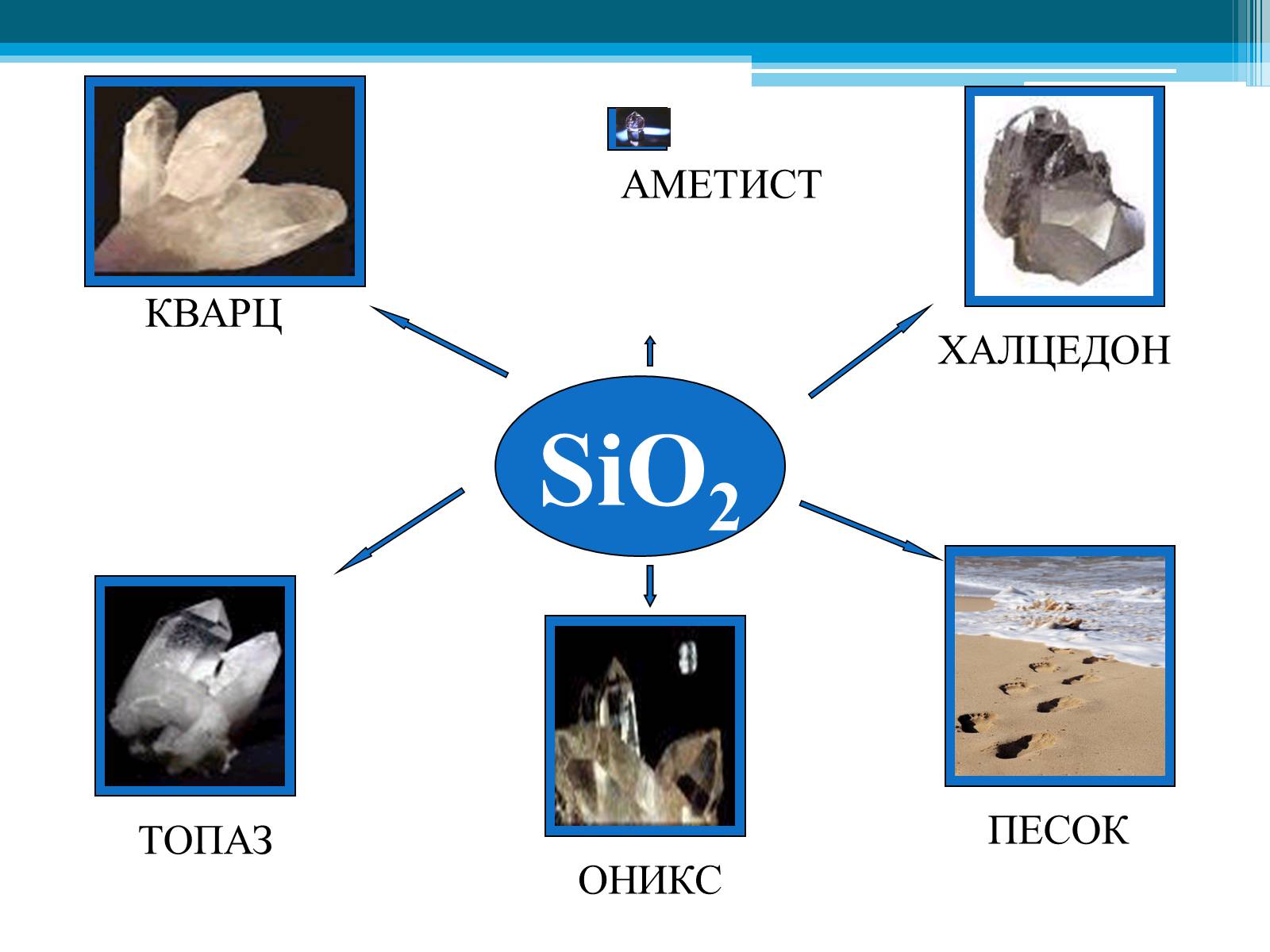
SiO2
ПЕСОК
ХАЛЦЕДОН
КВАРЦ
ОНИКС
ТОПАЗ
АМЕТИСТ
ПЕСОК
ХАЛЦЕДОН
КВАРЦ
ОНИКС
ТОПАЗ
АМЕТИСТ
Слайд #31
Аллотропия
Аллотро́пия (от др-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм.
Аллотро́пия (от др-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм.

Слайд #32
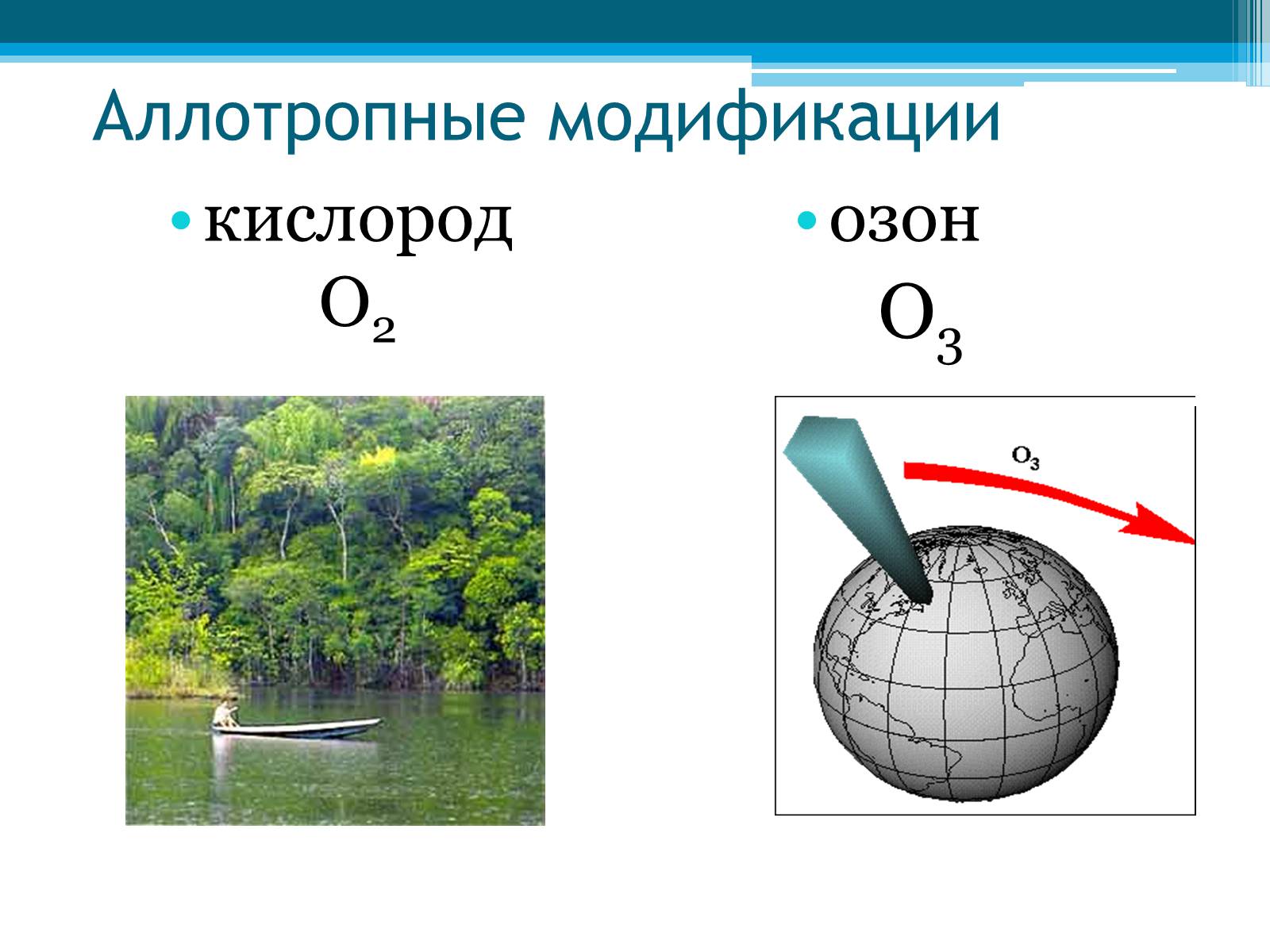
Аллотропные модификации
кислород О2
озон
О3
кислород О2
озон
О3
Слайд #33
Аллотропные модификации
кислород О2
озон
О3
кислород О2
озон
О3
Слайд #34
Аллотропные модификации
кислород О2
озон
О3
кислород О2
озон
О3
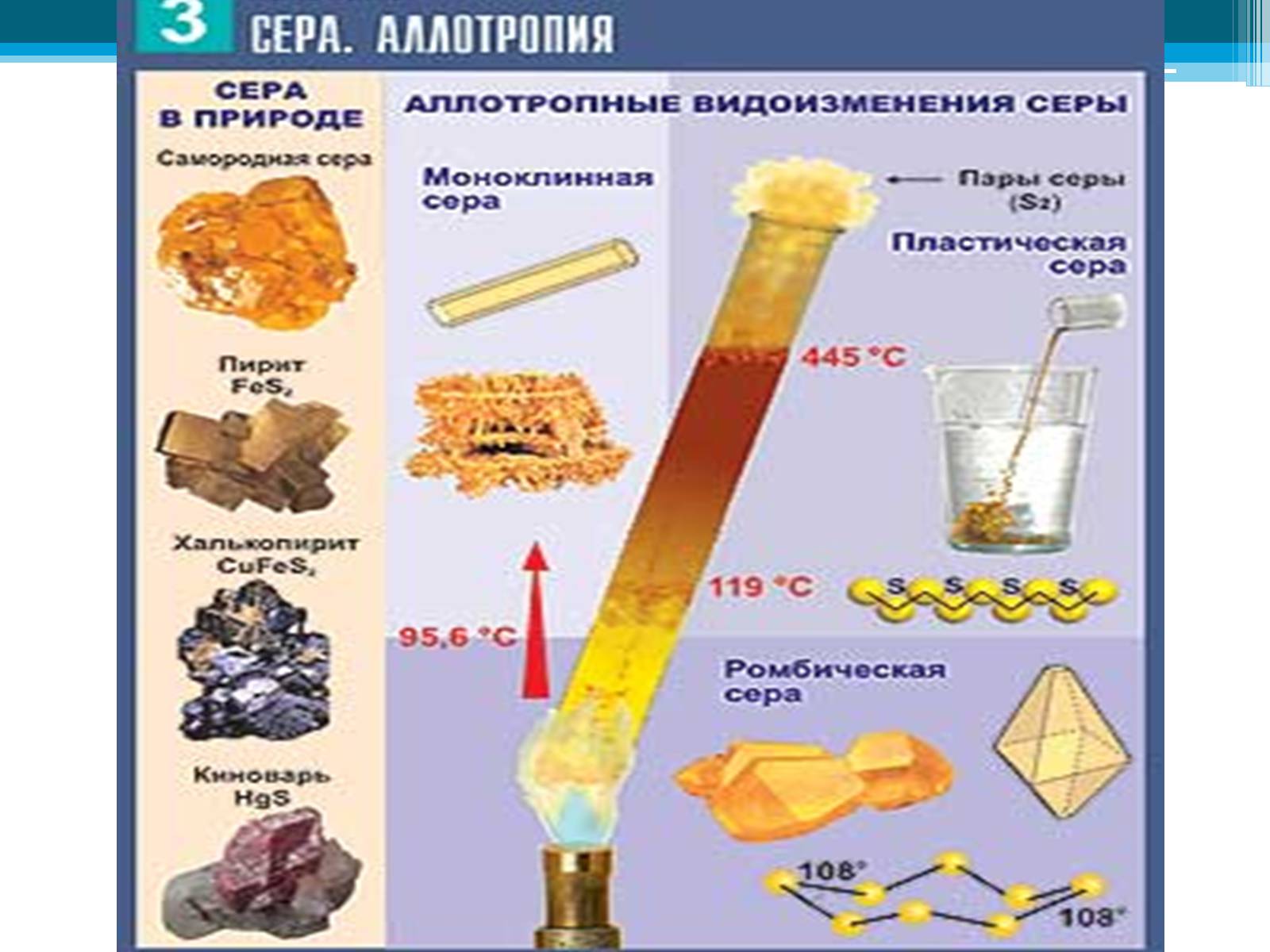
Слайд #35
Аллотропные видоизмененияфосфора
Белый фосфор
Красный фосфор
Белый фосфор
Красный фосфор

Слайд #36
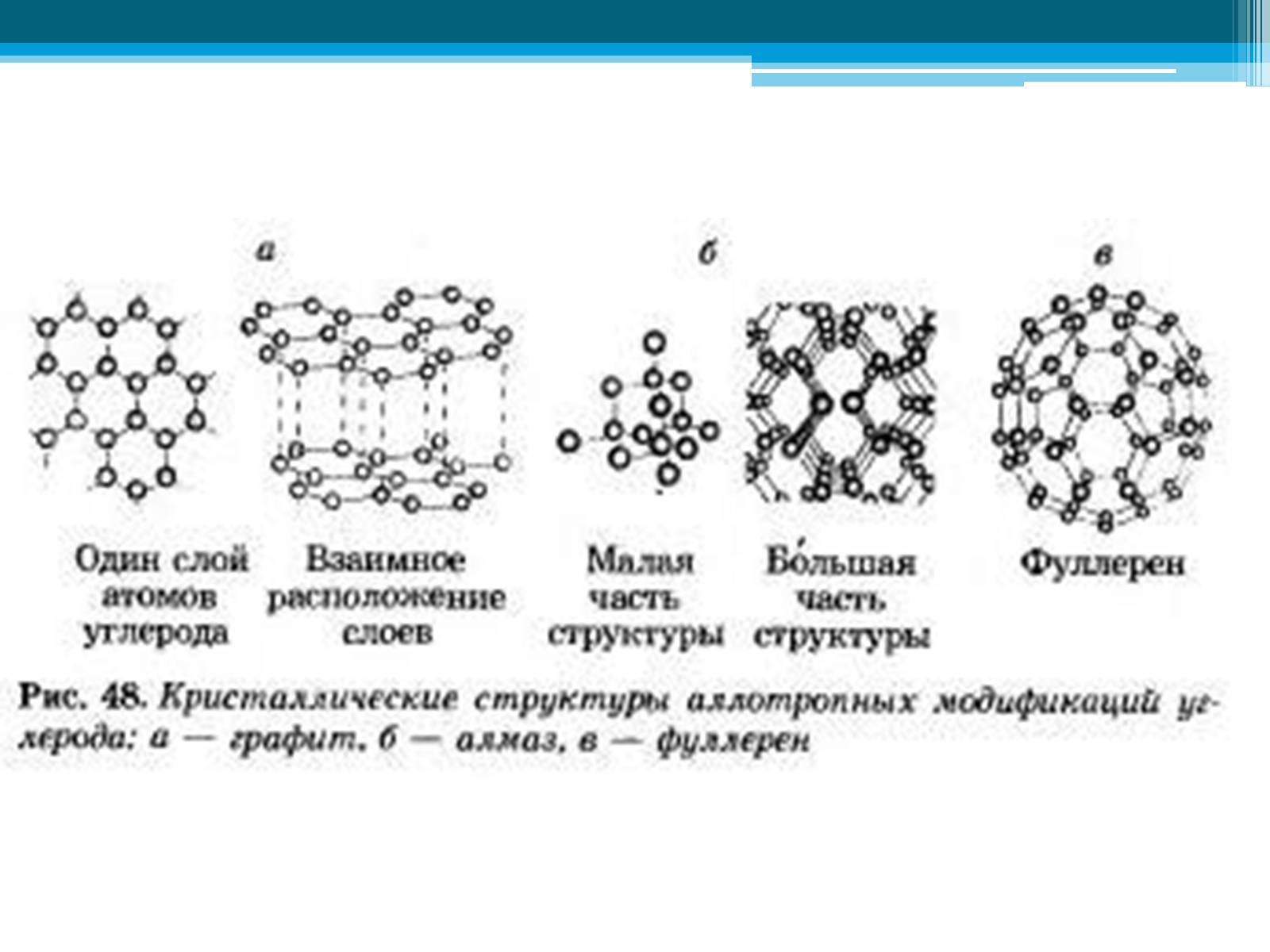
Аллотропия углерода
алмаз
графит
алмаз
графит

Слайд #37
АЛЛОТРОПИЯ(ответьте на вопросы)
Что такое аллотропия?
Чем вызвано явление аллотропии?
Что такое аллотропия?
Чем вызвано явление аллотропии?

Слайд #38
Перед вами фотографии различных веществ, найдите среди них неметаллы, попробуйте догадаться о каком неметалле идет речь, объясните ваш выбор.
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9

Слайд #39
Конфигурация внешнего электронного слоя

Слайд #40
Конфигурация внешнего электронного слоя

Слайд #41