- Головна
- Готові шкільні презентації
- Презентація на тему «Химическая связь и строение атома»
Презентація на тему «Химическая связь и строение атома»
191
Слайд #1
Химическая связь и строение атома

Слайд #2
Понятие о химической связи
Химическая связь – это связь между атомами, обеспечивающая существование веществ с четко определенным составом. При образовании ковалентной химической связи важную роль в уменьшении полной энергии играет обменное взаимодействие.
Ковалентная связь
Ионная связь
Виды химической связи:
Химическая связь – это связь между атомами, обеспечивающая существование веществ с четко определенным составом. При образовании ковалентной химической связи важную роль в уменьшении полной энергии играет обменное взаимодействие.
Ковалентная связь
Ионная связь
Виды химической связи:

Слайд #3
Виды ковалентной связи :
Ковалентная неполярная связь – это связь с помощью общих электронных пар, равноудалённых от ядер обоих атомов.
Ковалентная полярная связь – это химическая связь с помощью общих электронных пар, которые смещены в сторону более электроотрицательного атома.
Ковалентная неполярная связь – это связь с помощью общих электронных пар, равноудалённых от ядер обоих атомов.
Ковалентная полярная связь – это химическая связь с помощью общих электронных пар, которые смещены в сторону более электроотрицательного атома.

Слайд #4
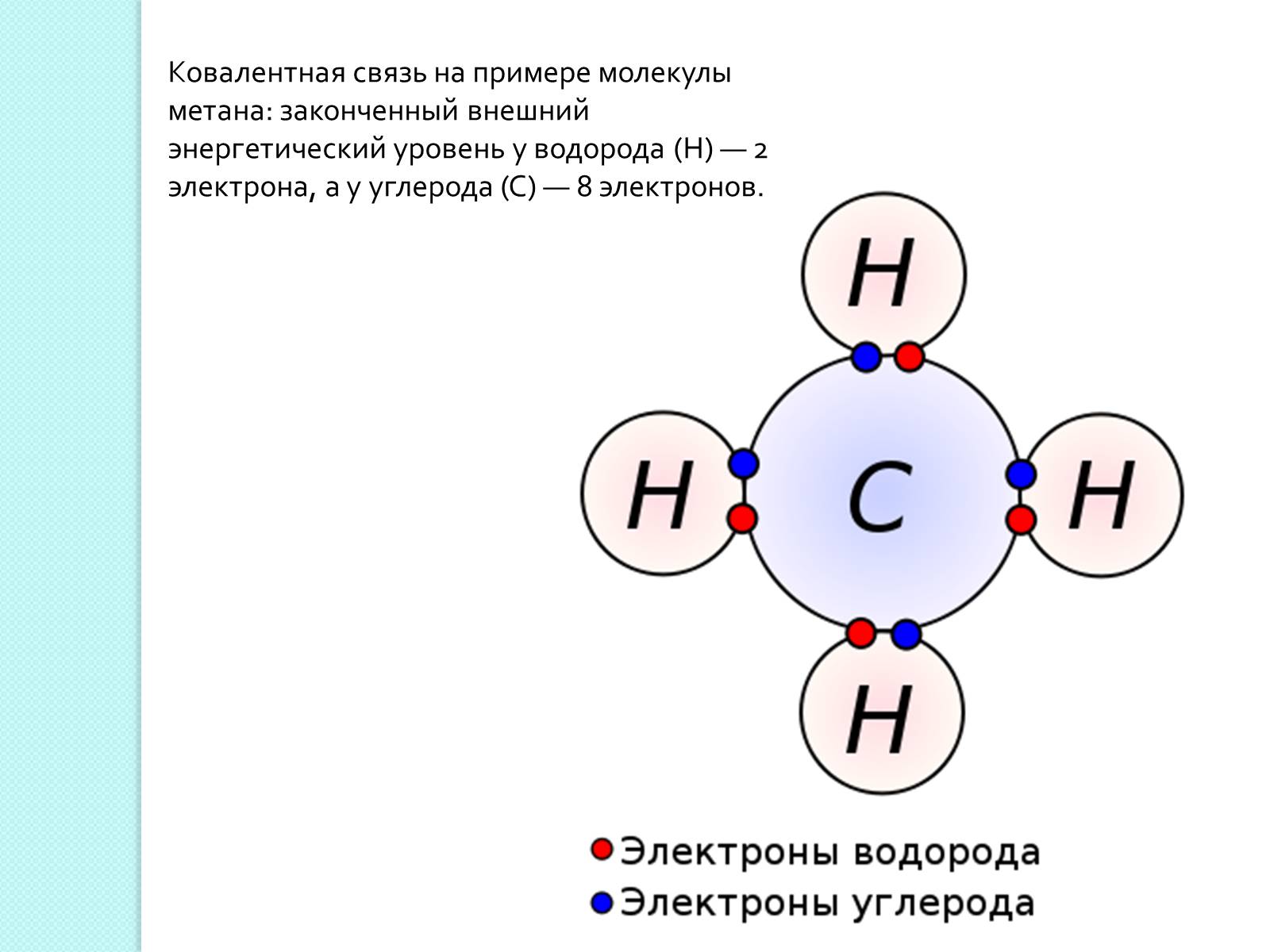
Ковалентная связь на примере молекулы метана: законченный внешний энергетический уровень у водорода (H) — 2 электрона, а у углерода (C) — 8 электронов.
Слайд #5
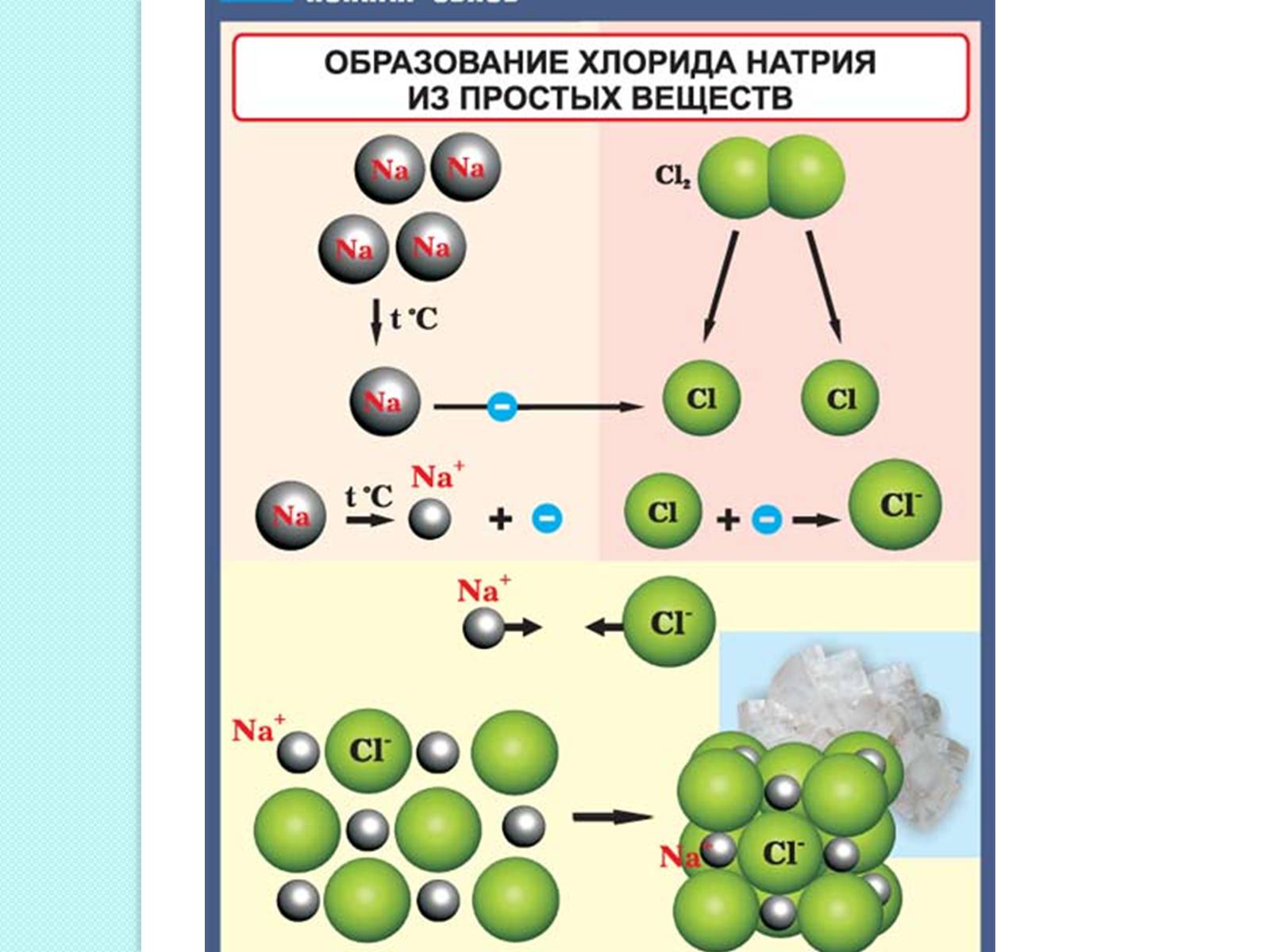
Ионная связь - прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.
Вид химической связи :
Вид химической связи :

Слайд #6
Ионная связь - прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.
Вид химической связи :
Вид химической связи :
Слайд #7
Электроотрицательность элементов
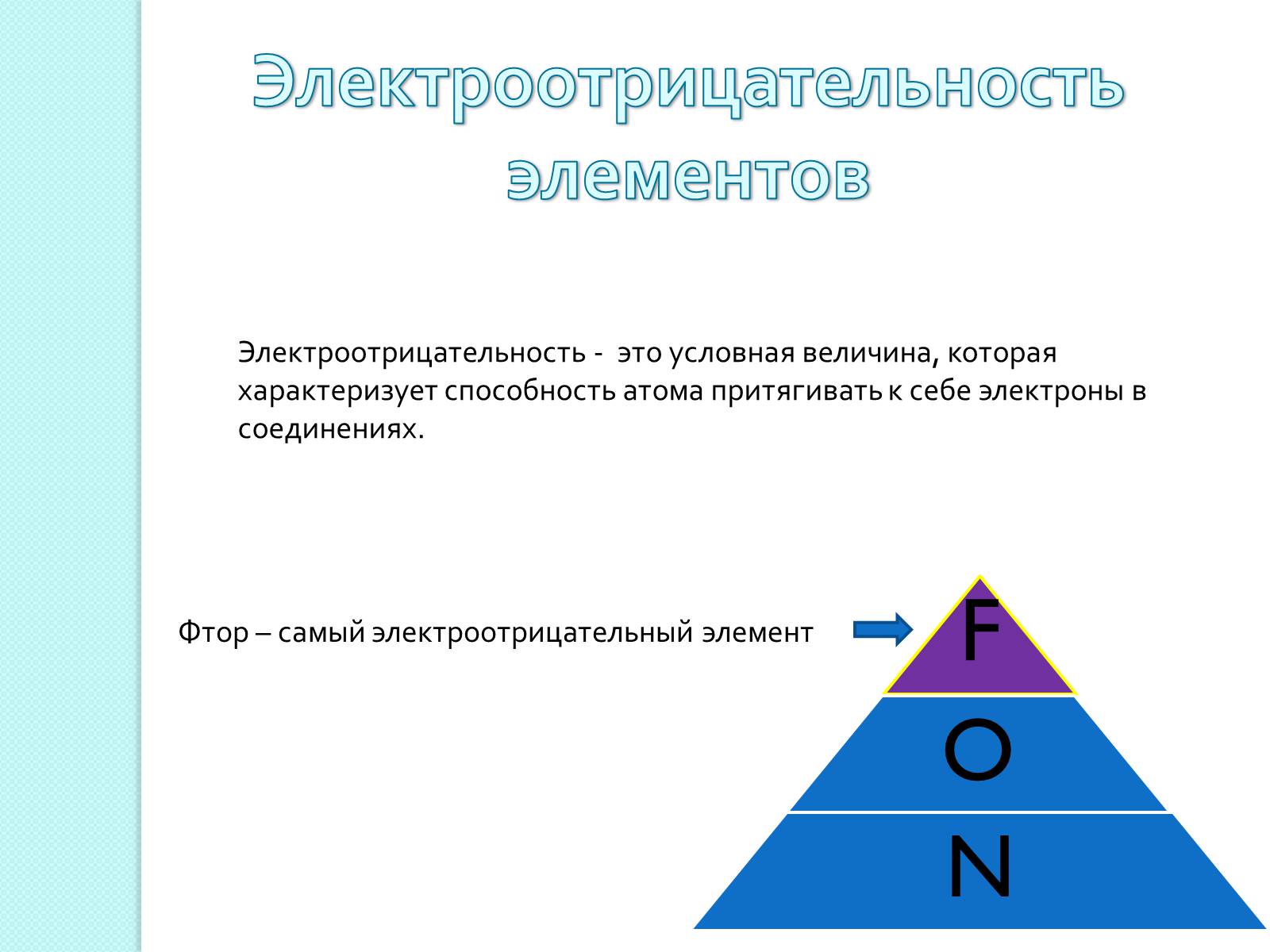
Электроотрицательность - это условная величина, которая характеризует способность атома притягивать к себе электроны в соединениях.
Фтор – самый электроотрицательный элемент
Электроотрицательность - это условная величина, которая характеризует способность атома притягивать к себе электроны в соединениях.
Фтор – самый электроотрицательный элемент
Слайд #8
F, O, N, Cl, Br, S, P, C, H, Si, Al, Mg, Ca, Na, K, Cs
Ряд электроотрицательности
Ряд электроотрицательности

Слайд #9
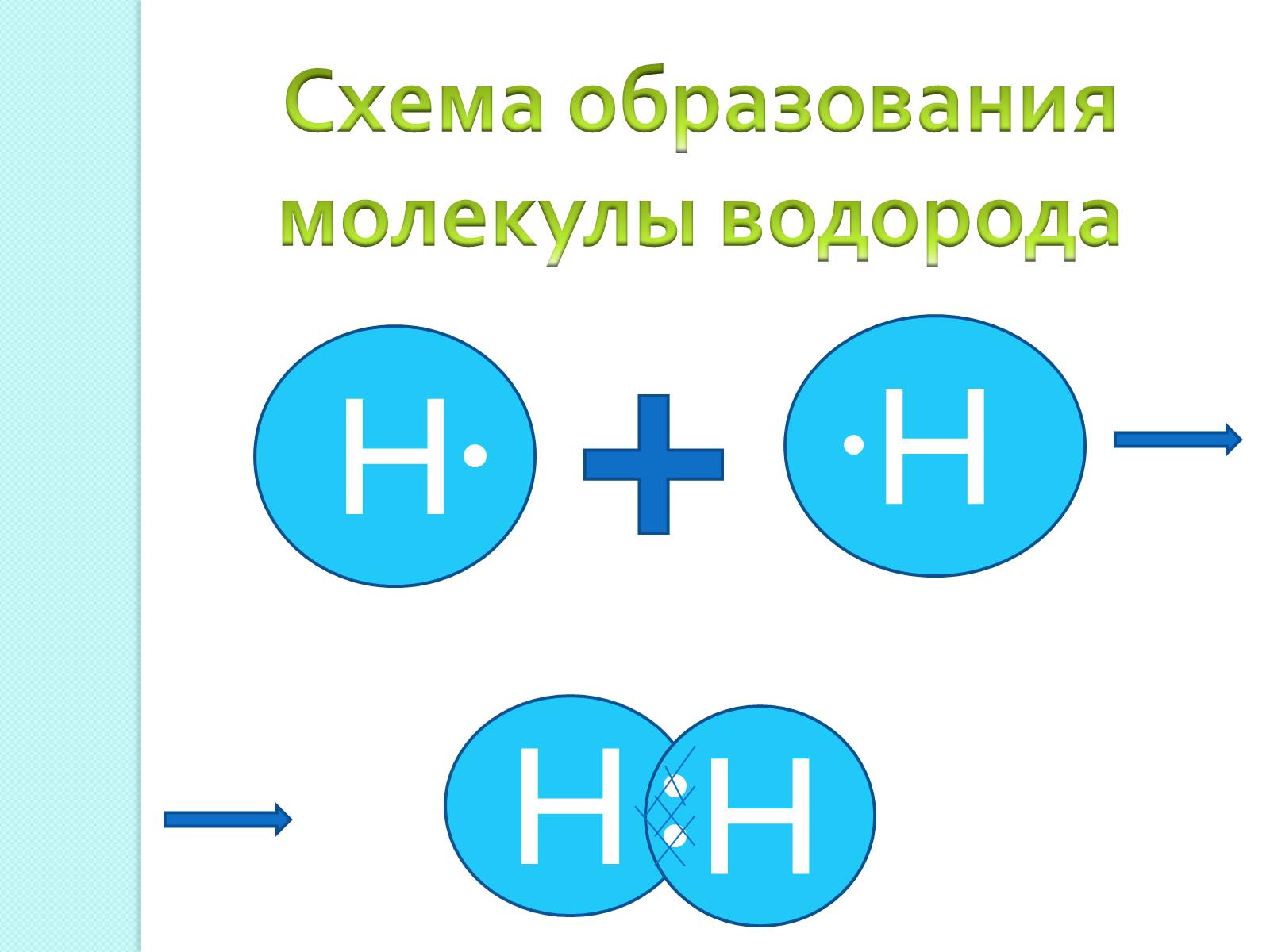
Схема образования молекулы водорода
H
H
H
H
H
H
H
H
Слайд #10
Кристаллические решетки
Ионные кристаллические решетки
Атомные кристаллические решетки
Молекулярные кристаллические решетки
Металлические кристаллические решетки
Ионные кристаллические решетки
Атомные кристаллические решетки
Молекулярные кристаллические решетки
Металлические кристаллические решетки

Слайд #11
Ионные кристаллические решетки
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов.
Связи между ионами в кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов.
Связи между ионами в кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.

Слайд #12
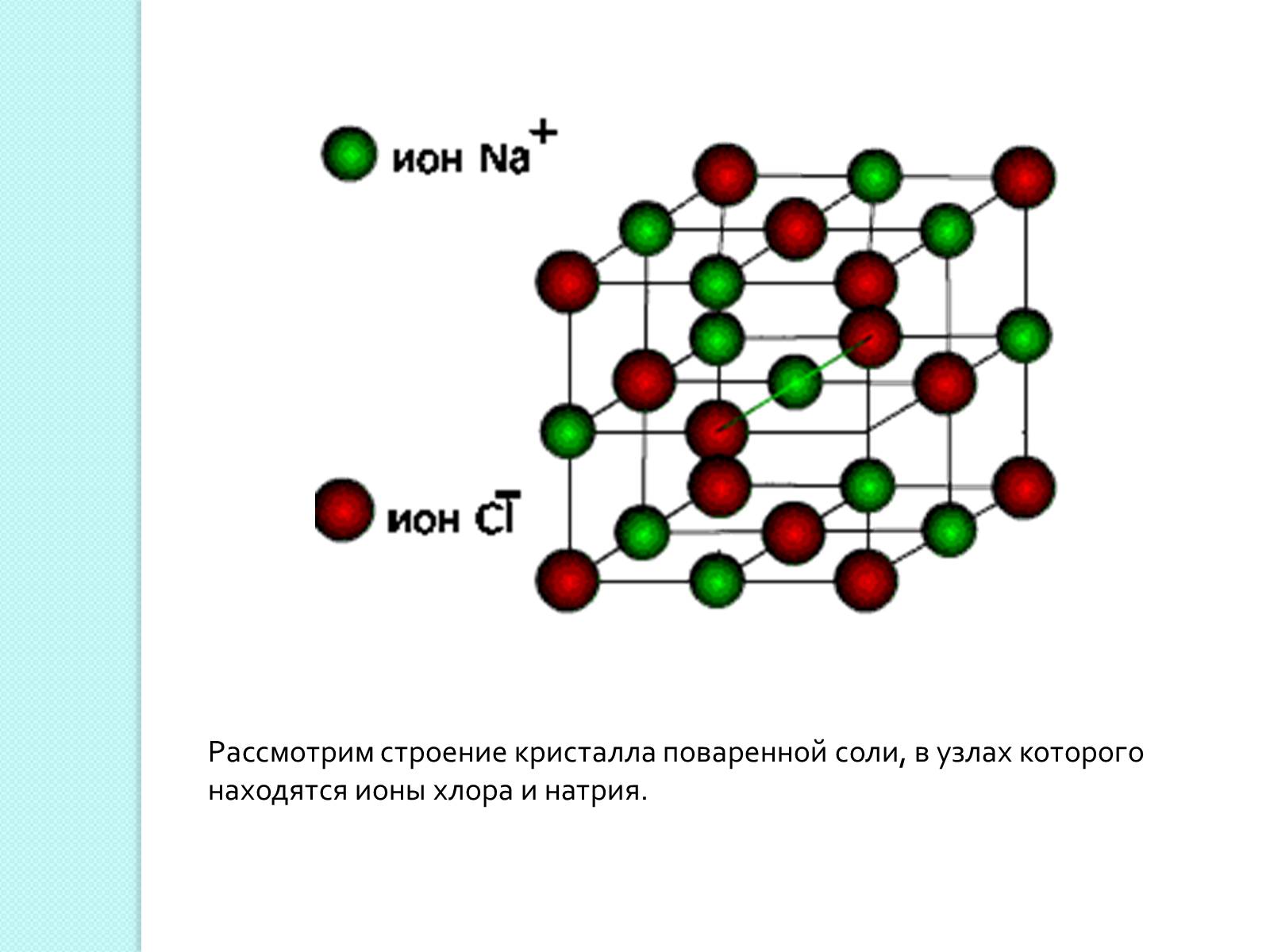
Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия.
Слайд #13
Атомные кристаллические решетки
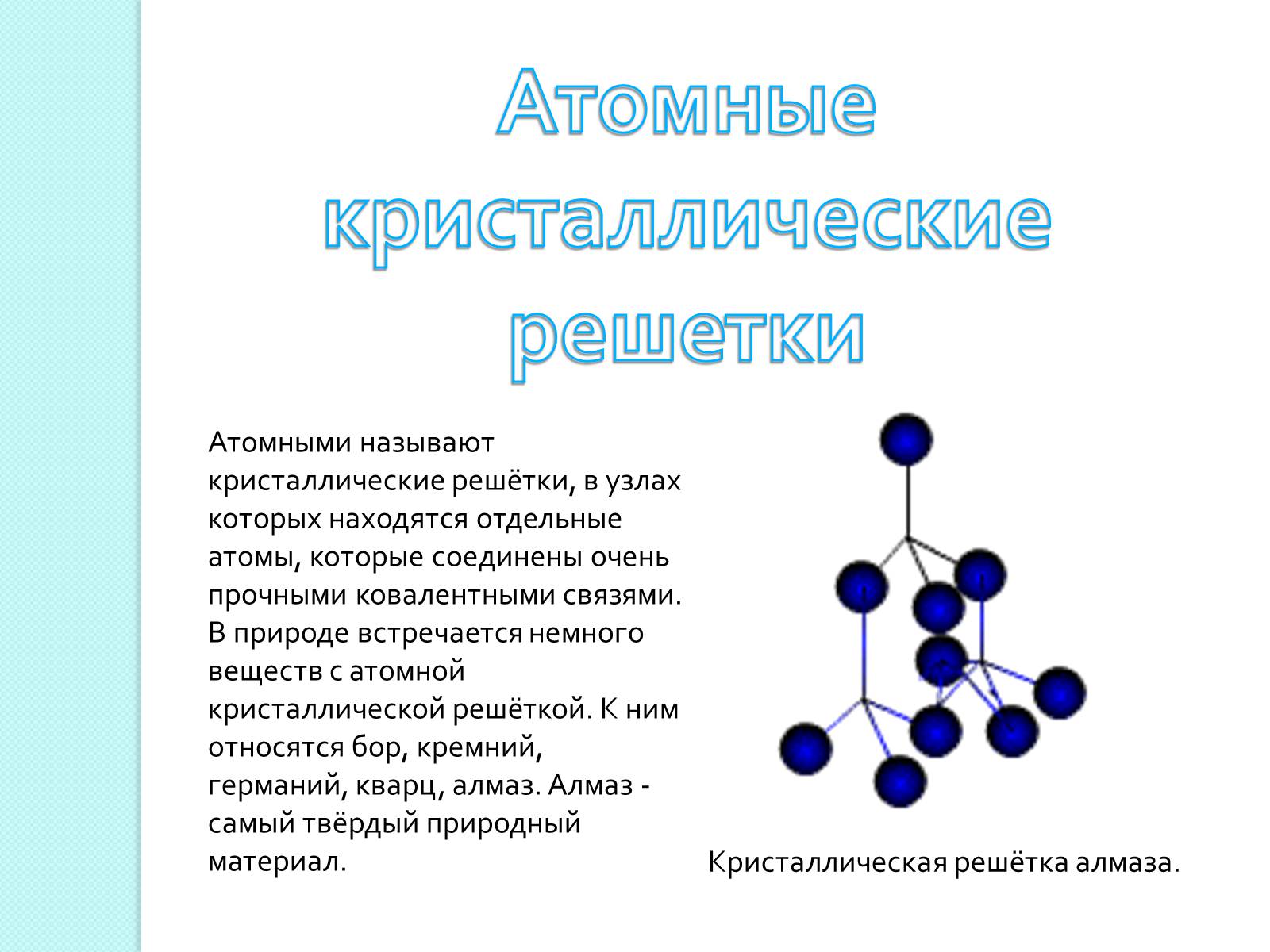
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными связями.
В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Алмаз - самый твёрдый природный материал.
Кристаллическая решётка алмаза.
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными связями.
В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Алмаз - самый твёрдый природный материал.
Кристаллическая решётка алмаза.
Слайд #14
Молекулярные кристаллические решетки
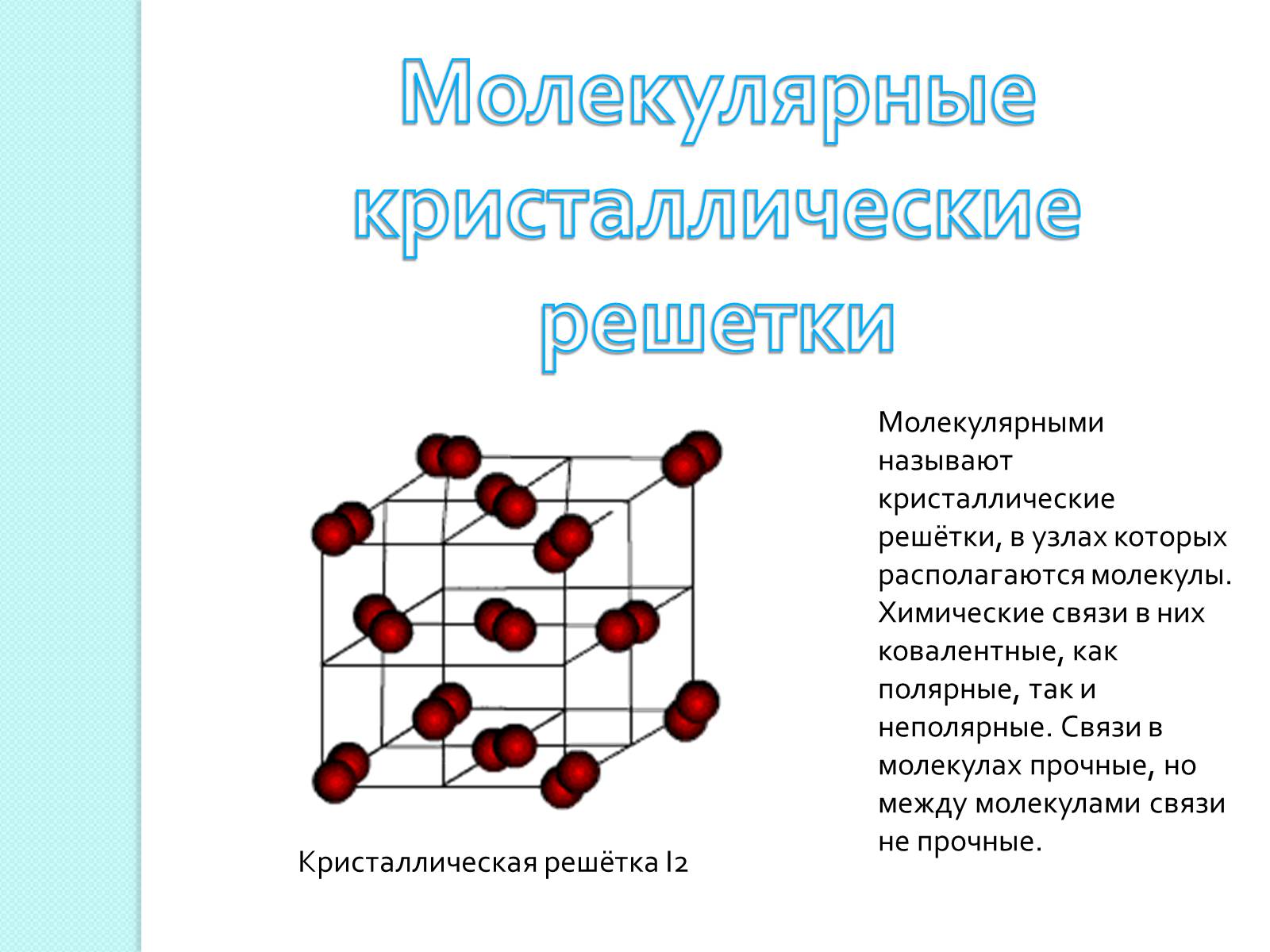
Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные.
Кристаллическая решётка I2
Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные.
Кристаллическая решётка I2
Слайд #15
Металлические кристаллические решетки
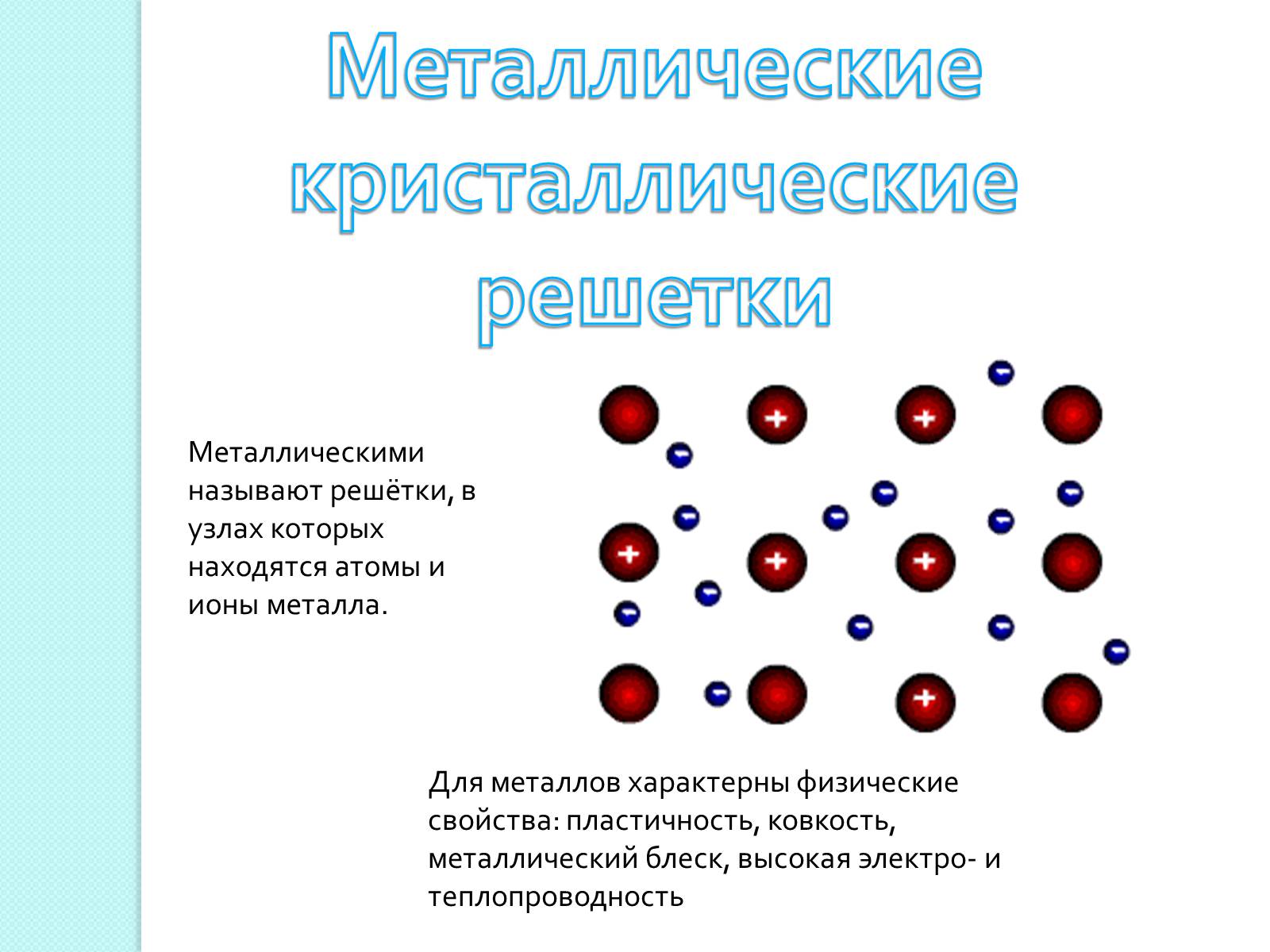
Металлическими называют решётки, в узлах которых находятся атомы и ионы металла.
Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность
Металлическими называют решётки, в узлах которых находятся атомы и ионы металла.
Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность
Слайд #16
Два изображения кристаллической решетки галита

Слайд #17
Степень окисления
Степень окисления – это условно принятый электрический заряд, который имел бы атом данного элемента в соединении, если бы все связи в нем были ионными.
Степень окисления – это условно принятый электрический заряд, который имел бы атом данного элемента в соединении, если бы все связи в нем были ионными.

Слайд #18
Определение степени окисления атома элемента по химической формуле соединения :
Степень окисления элемента в простом веществе равна нулю (электроотрицательность атомов одинакова).
Металлические элементы в соединениях с неметаллическими всегда имеют положительную степень окисления (их электроотрицательность мала и электроны смещаются к атомам неметаллических элементов).
Неметаллические элементы в соединениях с металлическими всегда имеют отрицательную степень окисления (их электроотрицательность больше, чем у металлических элементов).
Водород в соединениях имеет степень окисления +1 (за исключением бинарных соединениях с металлическими элементами).
Кислород в соединениях имеет степень окисления -2 (за исключением соединений с фтором, пероксида водорода H2O2 и т. п.)
Величина степени окисления атома в соединении равна числу валентных электронов, которые приняли участие в образовании химической связи.
Алгебраическая сумма степеней окисления всех атомов в соединении равна нулю
В бинарном соединении неметаллов положительную степень окисления имеет элемент с меньшей электроотрицательностью.
Степень окисления элемента в простом веществе равна нулю (электроотрицательность атомов одинакова).
Металлические элементы в соединениях с неметаллическими всегда имеют положительную степень окисления (их электроотрицательность мала и электроны смещаются к атомам неметаллических элементов).
Неметаллические элементы в соединениях с металлическими всегда имеют отрицательную степень окисления (их электроотрицательность больше, чем у металлических элементов).
Водород в соединениях имеет степень окисления +1 (за исключением бинарных соединениях с металлическими элементами).
Кислород в соединениях имеет степень окисления -2 (за исключением соединений с фтором, пероксида водорода H2O2 и т. п.)
Величина степени окисления атома в соединении равна числу валентных электронов, которые приняли участие в образовании химической связи.
Алгебраическая сумма степеней окисления всех атомов в соединении равна нулю
В бинарном соединении неметаллов положительную степень окисления имеет элемент с меньшей электроотрицательностью.

Слайд #19
Спасибо за внимание!!!
