- Головна
- Готові шкільні презентації
- Презентація на тему «Вуглеводи як компоненти їжі, їх роль у житті людини» (варіант 14)
Презентація на тему «Вуглеводи як компоненти їжі, їх роль у житті людини» (варіант 14)
240
Слайд #1
вУГЛЕВОДНІ
Презентація швеця максима
Презентація швеця максима

Слайд #2
вУГЛЕВОДні
Вперше термін «вуглеводи» запропонував російський хімік з Дерпта (нині Тарту) К.Шмідт в 1844 році.
Вперше термін «вуглеводи» запропонував російський хімік з Дерпта (нині Тарту) К.Шмідт в 1844 році.

Слайд #3
вУГЛЕВОДні
Вуглеводи самі універсальні й найпоширеніші органічні речовини на Землі.
Клітини рослин багаті вуглеводами.
Особено їх багато в плодах і насінні.
Вуглеводи самі універсальні й найпоширеніші органічні речовини на Землі.
Клітини рослин багаті вуглеводами.
Особено їх багато в плодах і насінні.

Слайд #4
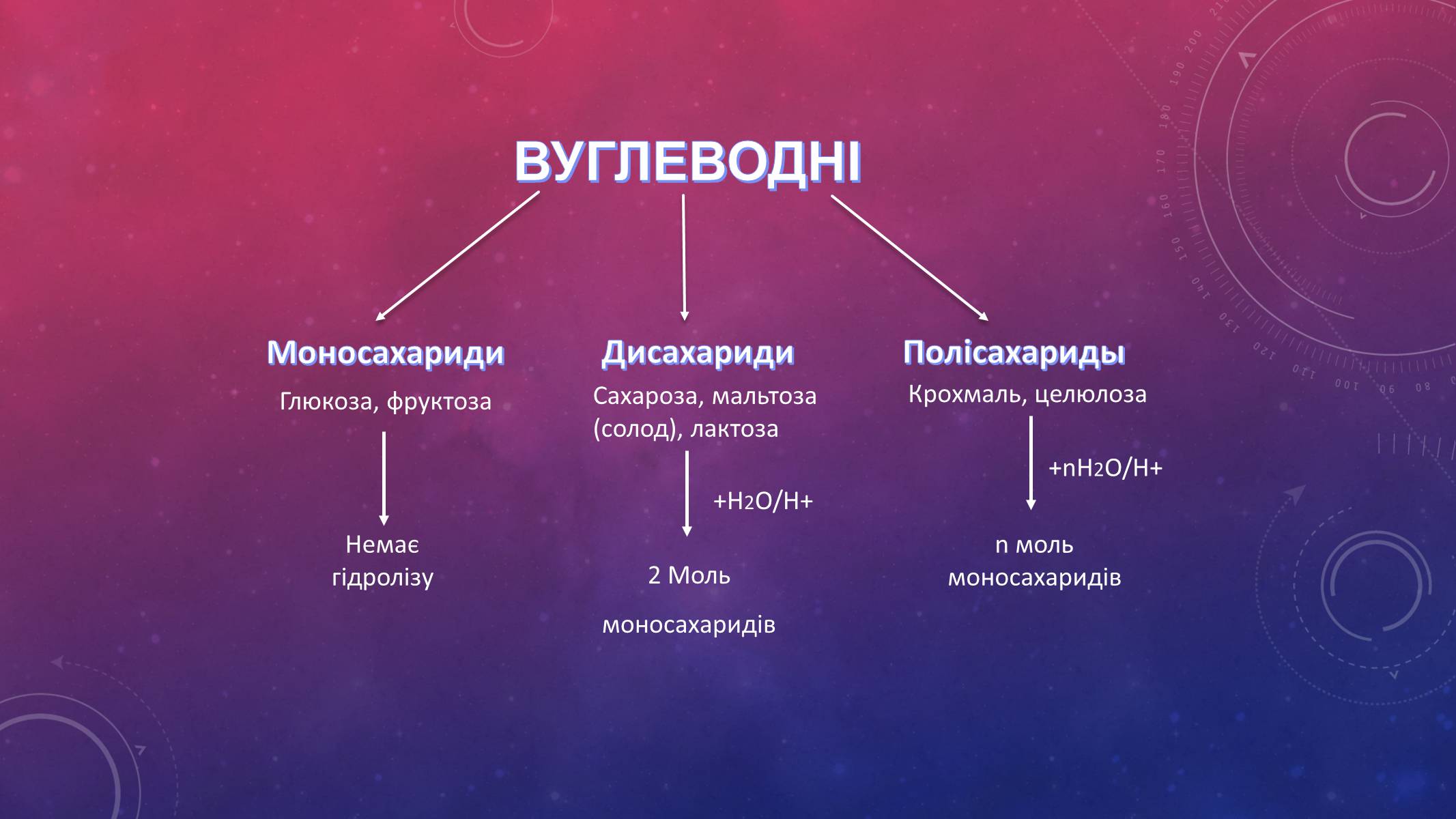
ВУГЛЕВОДНІ
Моносахариди
Дисахариди
Полісахариды
Глюкоза, фруктоза
Сахароза, мальтоза (солод), лактоза
Крохмаль, целюлоза
+H2O/H+
+nH2O/H+
Немає гідролізу
2 Моль
моносахаридів
n моль моносахаридів
Моносахариди
Дисахариди
Полісахариды
Глюкоза, фруктоза
Сахароза, мальтоза (солод), лактоза
Крохмаль, целюлоза
+H2O/H+
+nH2O/H+
Немає гідролізу
2 Моль
моносахаридів
n моль моносахаридів
Слайд #5
Структурні формули органічних речовин
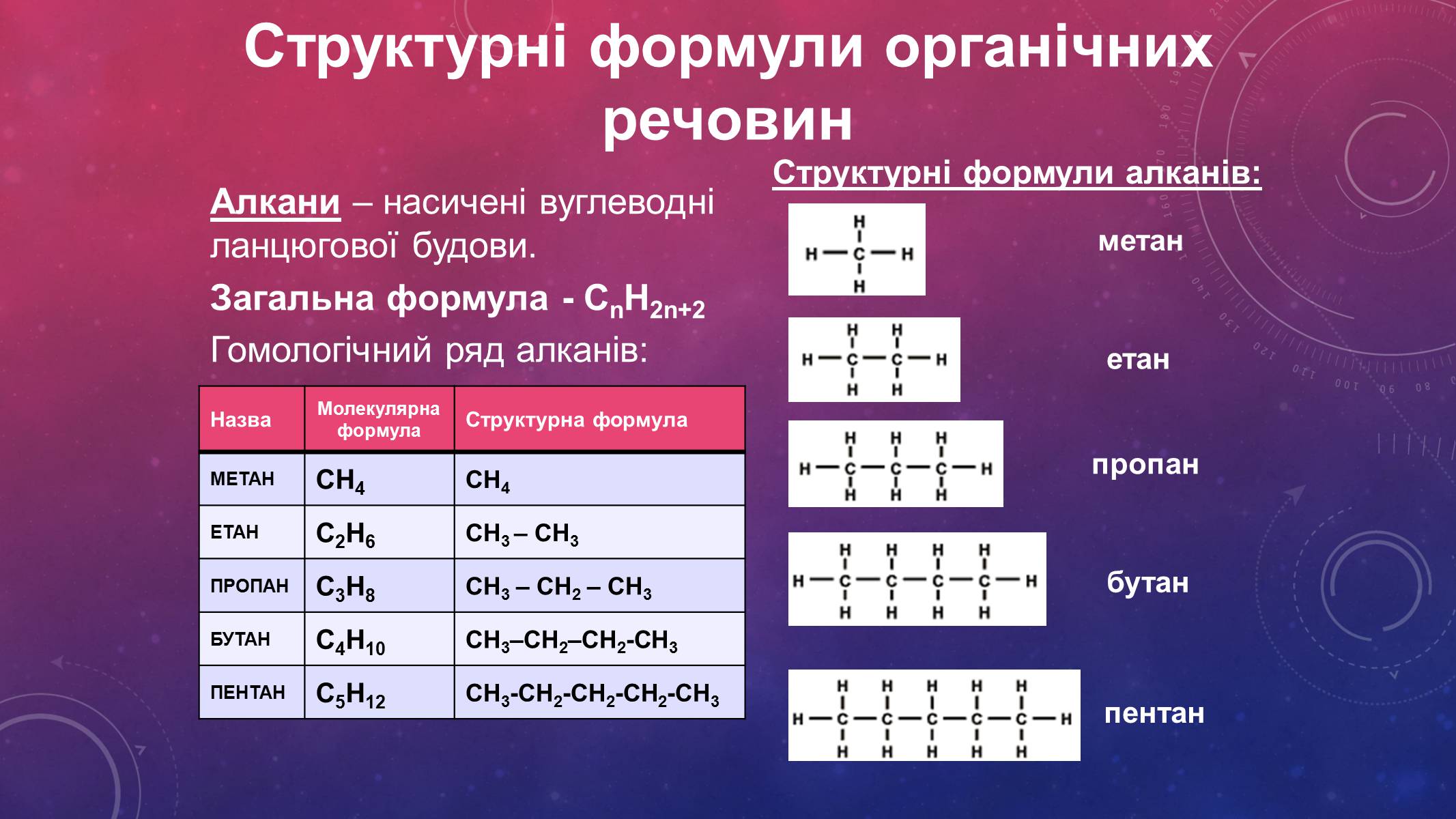
Алкани – насичені вуглеводні ланцюгової будови.
Загальна формула - СnH2n+2
Гомологічний ряд алканів:
Назва
Молекулярна формула
Структурна формула
МЕТАН
СН4
СН4
ЕТАН
С2Н6
СН3 – СН3
ПРОПАН
С3Н8
СН3 – СН2 – СН3
БУТАН
С4Н10
СН3–СН2–СН2-СН3
ПЕНТАН
С5Н12
СН3-СН2-СН2-СН2-СН3
метан
етан
пропан
бутан
пентан
Структурні формули алканів:
Алкани – насичені вуглеводні ланцюгової будови.
Загальна формула - СnH2n+2
Гомологічний ряд алканів:
Назва
Молекулярна формула
Структурна формула
МЕТАН
СН4
СН4
ЕТАН
С2Н6
СН3 – СН3
ПРОПАН
С3Н8
СН3 – СН2 – СН3
БУТАН
С4Н10
СН3–СН2–СН2-СН3
ПЕНТАН
С5Н12
СН3-СН2-СН2-СН2-СН3
метан
етан
пропан
бутан
пентан
Структурні формули алканів:
Слайд #6
Ненасичені вуглеводні – органічні сполуки, що мають кратні зв'язки між атомами Карбону (подвійні – С = С – або потрійні – С Ξ С – )
Етиленові вуглеводні - органічні сполуки, що мають один подвійний зв'язок між атомами Карбону.
Загальна формула СnH2n
С2Н4 - етен (етилен)
С3Н6 - пропен
С4Н8 - бутен
Ацетиленові вуглеводні - органічні сполуки, що мають один потрійний зв'язок між атомами Карбону.
Загальна формула
СnH2n - 2
С2Н2 - етин (ацетилен)
С3Н4 - пропін
С4Н6 - бутин
Етиленові вуглеводні - органічні сполуки, що мають один подвійний зв'язок між атомами Карбону.
Загальна формула СnH2n
С2Н4 - етен (етилен)
С3Н6 - пропен
С4Н8 - бутен
Ацетиленові вуглеводні - органічні сполуки, що мають один потрійний зв'язок між атомами Карбону.
Загальна формула
СnH2n - 2
С2Н2 - етин (ацетилен)
С3Н4 - пропін
С4Н6 - бутин

Слайд #7
загальна формула
кратні зв'язки
тип гібридизації
кут між напрямами зв'язку
Алкени
Алкіни
CnH2n
CnH2n-2
С
С
С
С
sp2
sp
1s + 2p = 3sp2
1s + 1p = 2sp
< 120◦
< 180◦
Ненасичені вуглеводні
кратні зв'язки
тип гібридизації
кут між напрямами зв'язку
Алкени
Алкіни
CnH2n
CnH2n-2
С
С
С
С
sp2
sp
1s + 2p = 3sp2
1s + 1p = 2sp
< 120◦
< 180◦
Ненасичені вуглеводні

Слайд #8
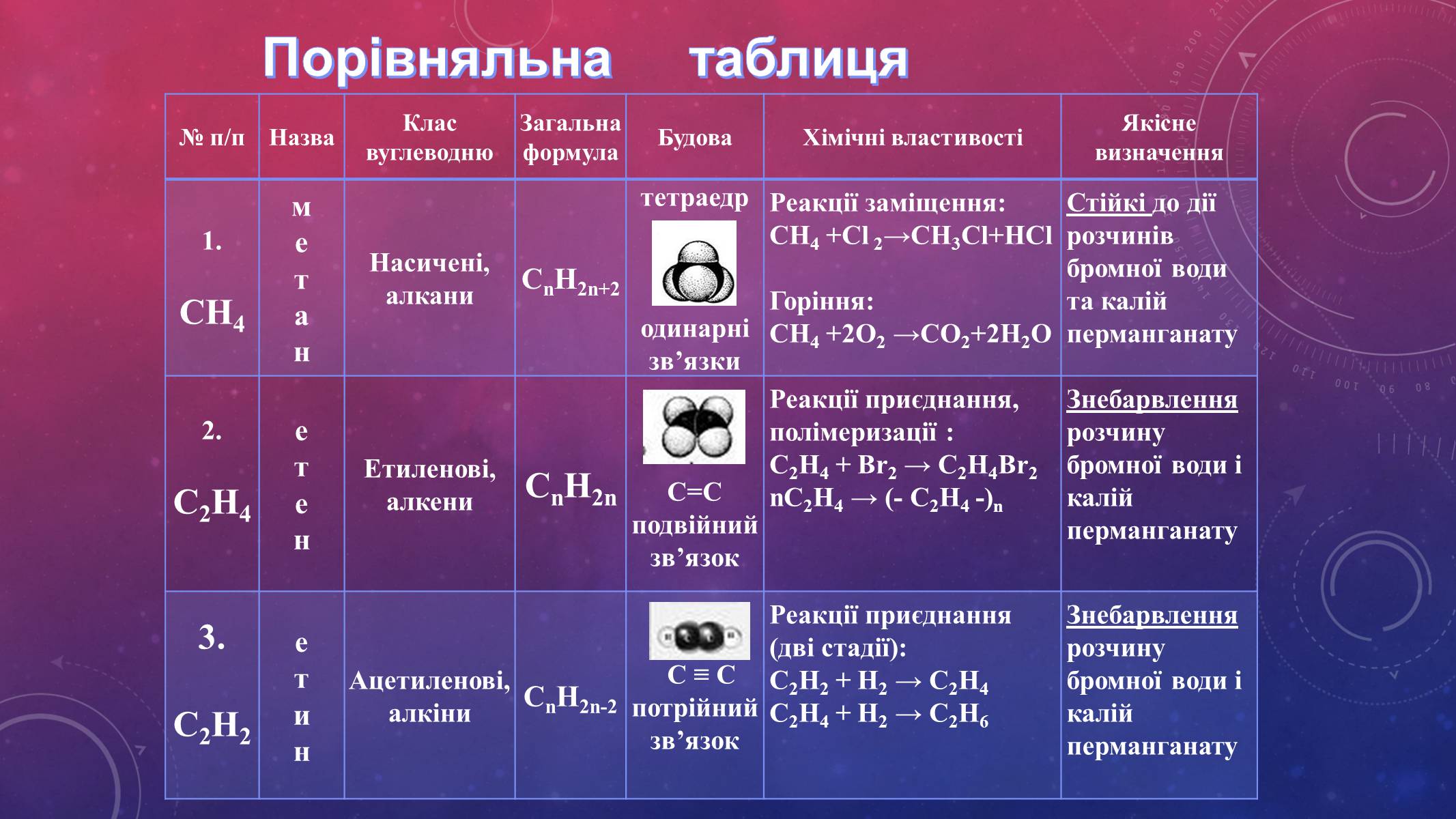
Порівняльна таблиця
№ п/п
Назва
Клас вуглеводню
Загальна формула
Будова
Хімічні властивості
Якісне визначення
1.
СН4
м
е
т
а
н
Насичені,
алкани
СnH2n+2
тетраедр
одинарні зв'язки
Реакції заміщення:
СН4 +Cl 2→СН3Cl+НCl
Горіння:
СН4 +2O2 →СО2+2Н2О
Стійкі до дії розчинів бромної води та калій перманганату
2.
С2Н4
е
т
е
н
Етиленові,
алкени
СnH2n
С=С
подвійний зв'язок
Реакції приєднання, полімеризації :
С2Н4 + Br2 → С2Н4Br2
nС2Н4 → (- С2Н4 -)n
Знебарвлення розчину бромної води і калій перманганату
3.
С2Н2
е
т
и
н
Ацетиленові,
алкіни
СnH2n-2
С ≡ С
потрійний
зв'язок
Реакції приєднання
(дві стадії):
С2Н2 + Н2 → С2Н4
С2Н4 + Н2 → С2Н6
Знебарвлення розчину бромної води і калій перманганату
№ п/п
Назва
Клас вуглеводню
Загальна формула
Будова
Хімічні властивості
Якісне визначення
1.
СН4
м
е
т
а
н
Насичені,
алкани
СnH2n+2
тетраедр
одинарні зв'язки
Реакції заміщення:
СН4 +Cl 2→СН3Cl+НCl
Горіння:
СН4 +2O2 →СО2+2Н2О
Стійкі до дії розчинів бромної води та калій перманганату
2.
С2Н4
е
т
е
н
Етиленові,
алкени
СnH2n
С=С
подвійний зв'язок
Реакції приєднання, полімеризації :
С2Н4 + Br2 → С2Н4Br2
nС2Н4 → (- С2Н4 -)n
Знебарвлення розчину бромної води і калій перманганату
3.
С2Н2
е
т
и
н
Ацетиленові,
алкіни
СnH2n-2
С ≡ С
потрійний
зв'язок
Реакції приєднання
(дві стадії):
С2Н2 + Н2 → С2Н4
С2Н4 + Н2 → С2Н6
Знебарвлення розчину бромної води і калій перманганату
Слайд #9
АЛКАНИ
CnH2n + 2
H2
t, kat
+ H2
t, kat
АЛКЕНИ
CnH2n
CnH2n + 2
H2
t, kat
+ H2
t, kat
АЛКЕНИ
CnH2n
Слайд #10
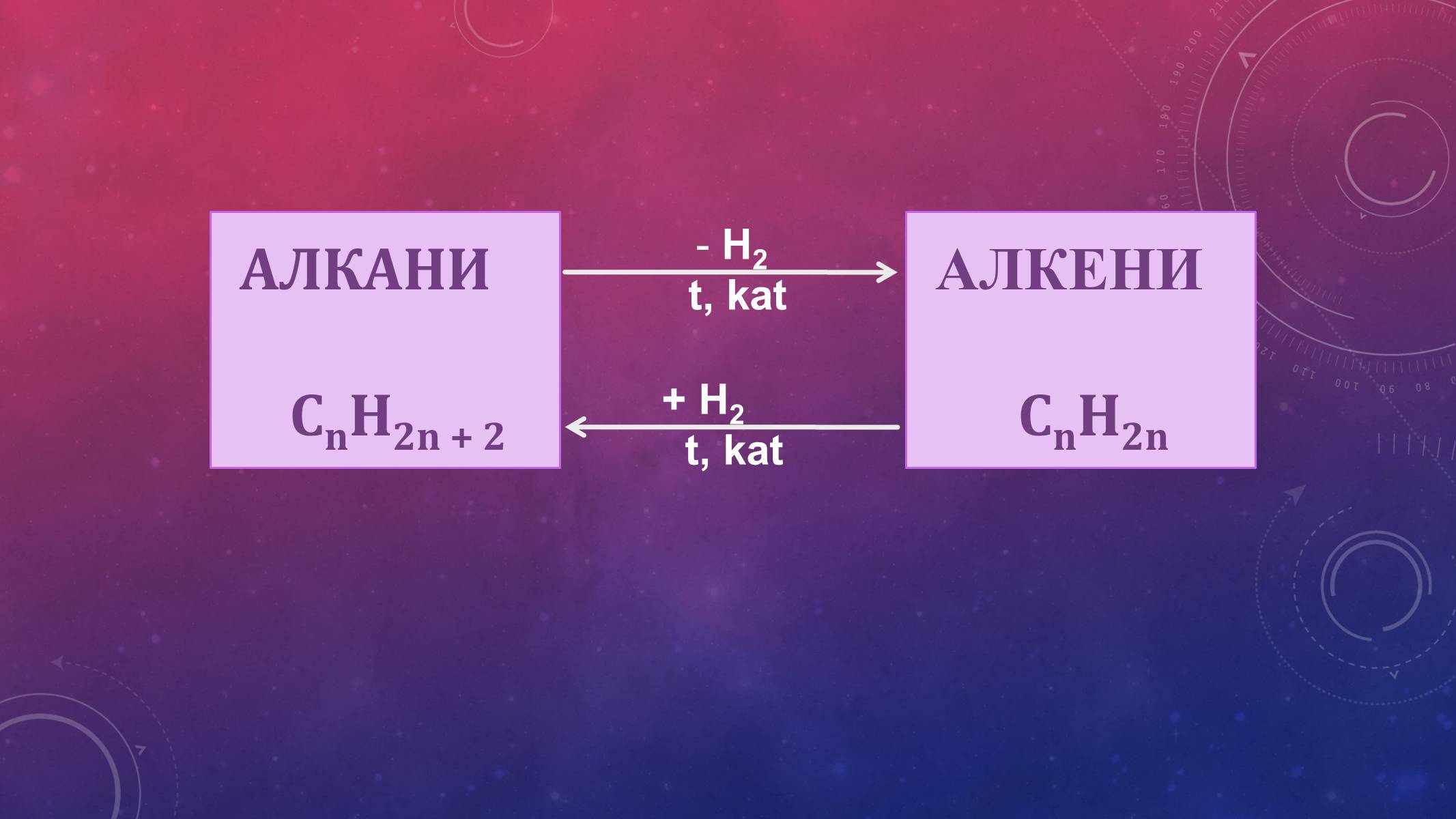
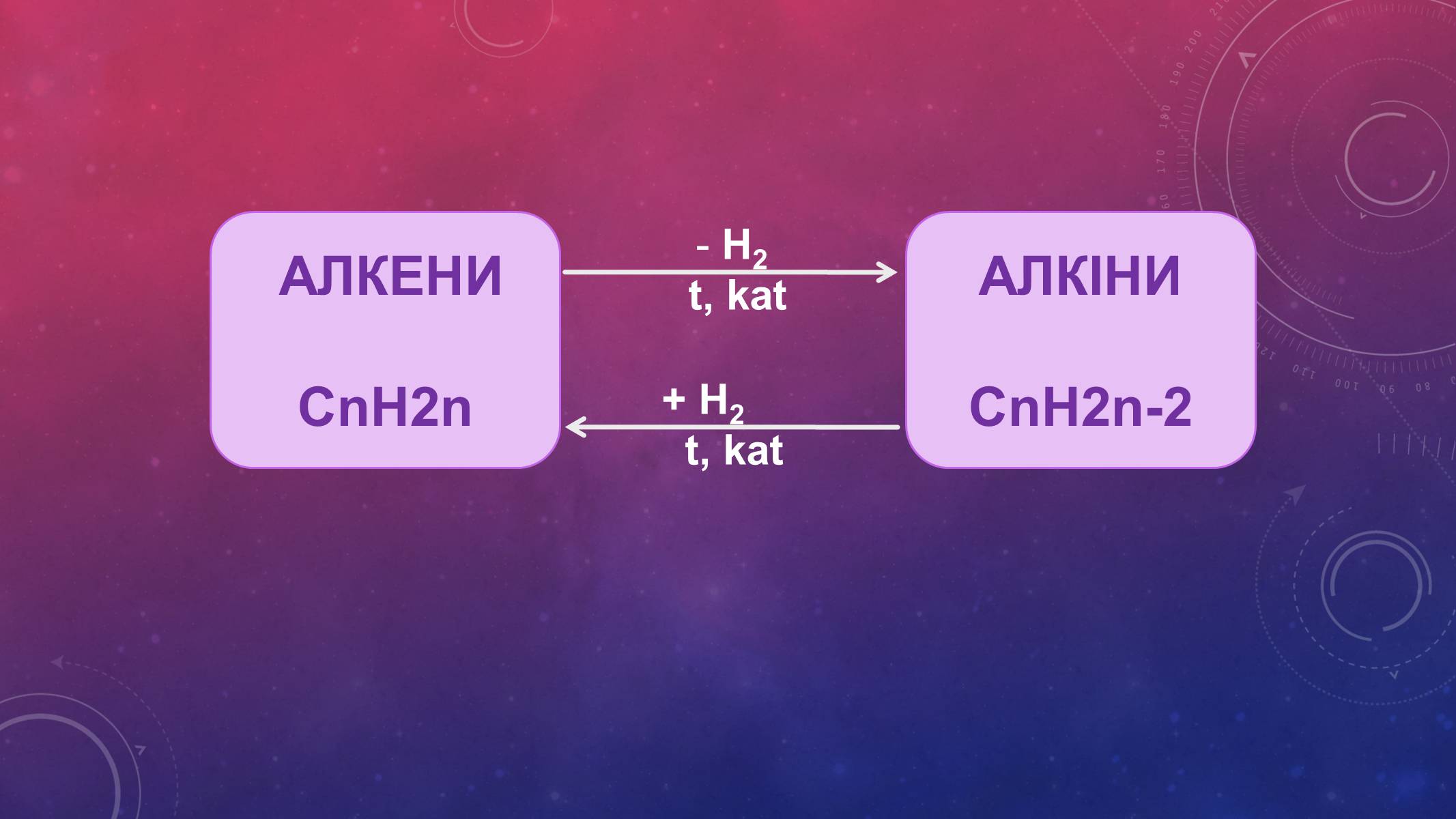
АЛКЕНИ
СnH2n
H2
t, kat
+ H2
t, kat
АЛКІНИ
СnH2n-2
СnH2n
H2
t, kat
+ H2
t, kat
АЛКІНИ
СnH2n-2
Слайд #11
Структурна формула бензену
Арени – ненасичені вуглеводні із загальною формулою CnH2n-6, молекули яких, містять бензольне кільце.
Молекулярна формула бензену
формула Кекуле
Ароматичні вуглеводні
Арени – ненасичені вуглеводні із загальною формулою CnH2n-6, молекули яких, містять бензольне кільце.
Молекулярна формула бензену
формула Кекуле
Ароматичні вуглеводні

Слайд #12
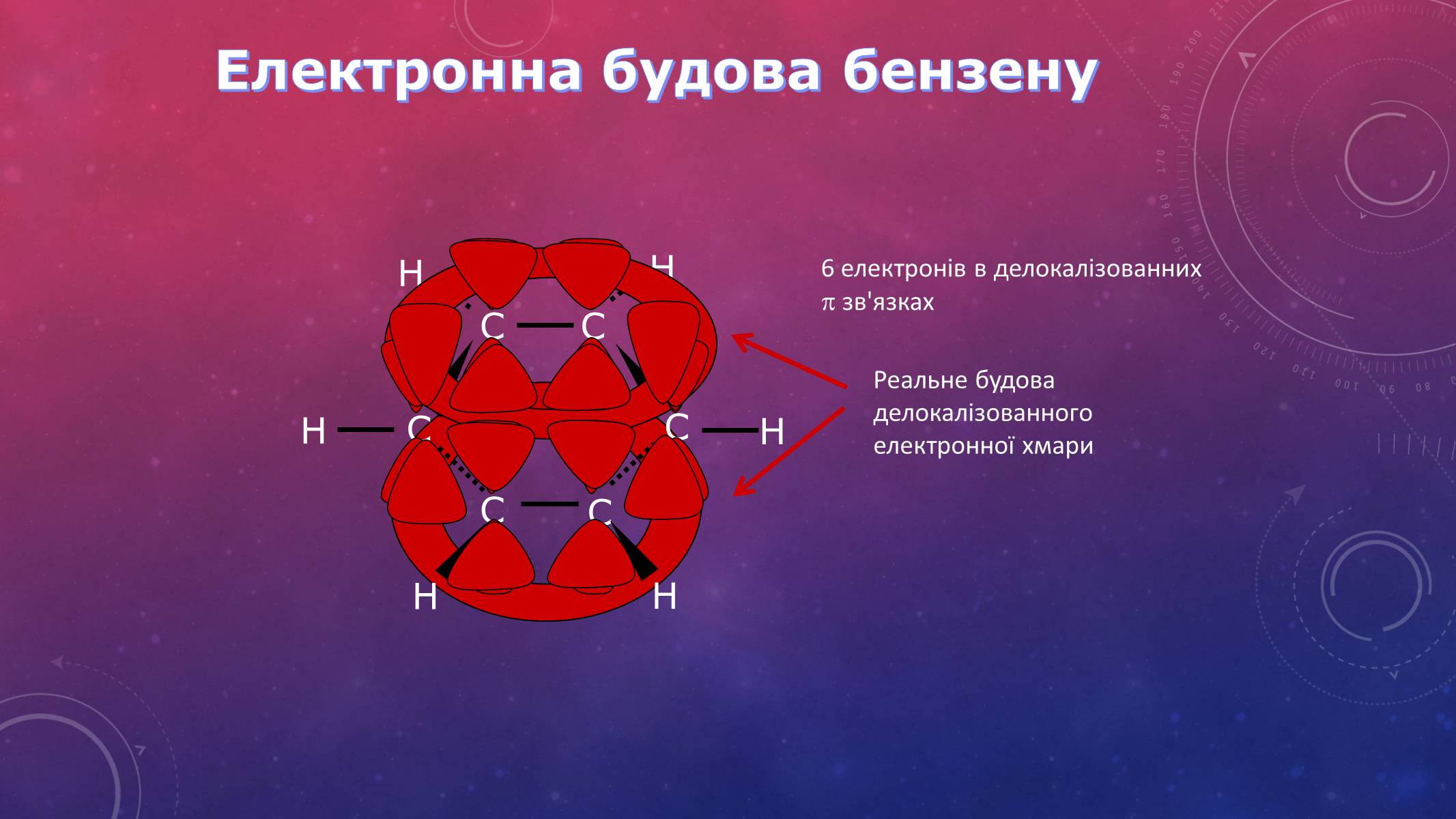
Електронна будова бензену
C
C
C
C
C
C
H
H
H
H
H
H
6 електронів в делокалізованних зв'язках
Реальне будова делокалізованного електронної хмари
C
C
C
C
C
C
H
H
H
H
H
H
6 електронів в делокалізованних зв'язках
Реальне будова делокалізованного електронної хмари
Слайд #13
Отримання бензену
Бензен є першим представником аренів. Його можна отримати трімерізаціей ацетилену.
Бензол отримують при переробці кам'яного вугілля, а також при риформінгу бензинів з низьким октановим числом.
Бензен є першим представником аренів. Його можна отримати трімерізаціей ацетилену.
Бензол отримують при переробці кам'яного вугілля, а також при риформінгу бензинів з низьким октановим числом.

Слайд #14
Фізичні властивості бензену
Бензен:
безбарвна рідина,
з різким характерним запахом,
легше води,
розчиняється у воді,
розчинний в органічних розчинниках.
Бензен токсичний, тому робота з ним в умовах школи неприпустима.
Бензен:
безбарвна рідина,
з різким характерним запахом,
легше води,
розчиняється у воді,
розчинний в органічних розчинниках.
Бензен токсичний, тому робота з ним в умовах школи неприпустима.

Слайд #15
Бензол горить. Полум'я бензолу кіптяве
з-за високого вмісту карбону в молекулі.
Хімічні властивості бензолу
Через особливого будови молекули, бензен займає проміжне положення між алканами і алкенами, тобто може вступати в реакції приєднання і в реакції заміщення.
з-за високого вмісту карбону в молекулі.
Хімічні властивості бензолу
Через особливого будови молекули, бензен займає проміжне положення між алканами і алкенами, тобто може вступати в реакції приєднання і в реакції заміщення.

Слайд #16
Хімічні властивості бензолу
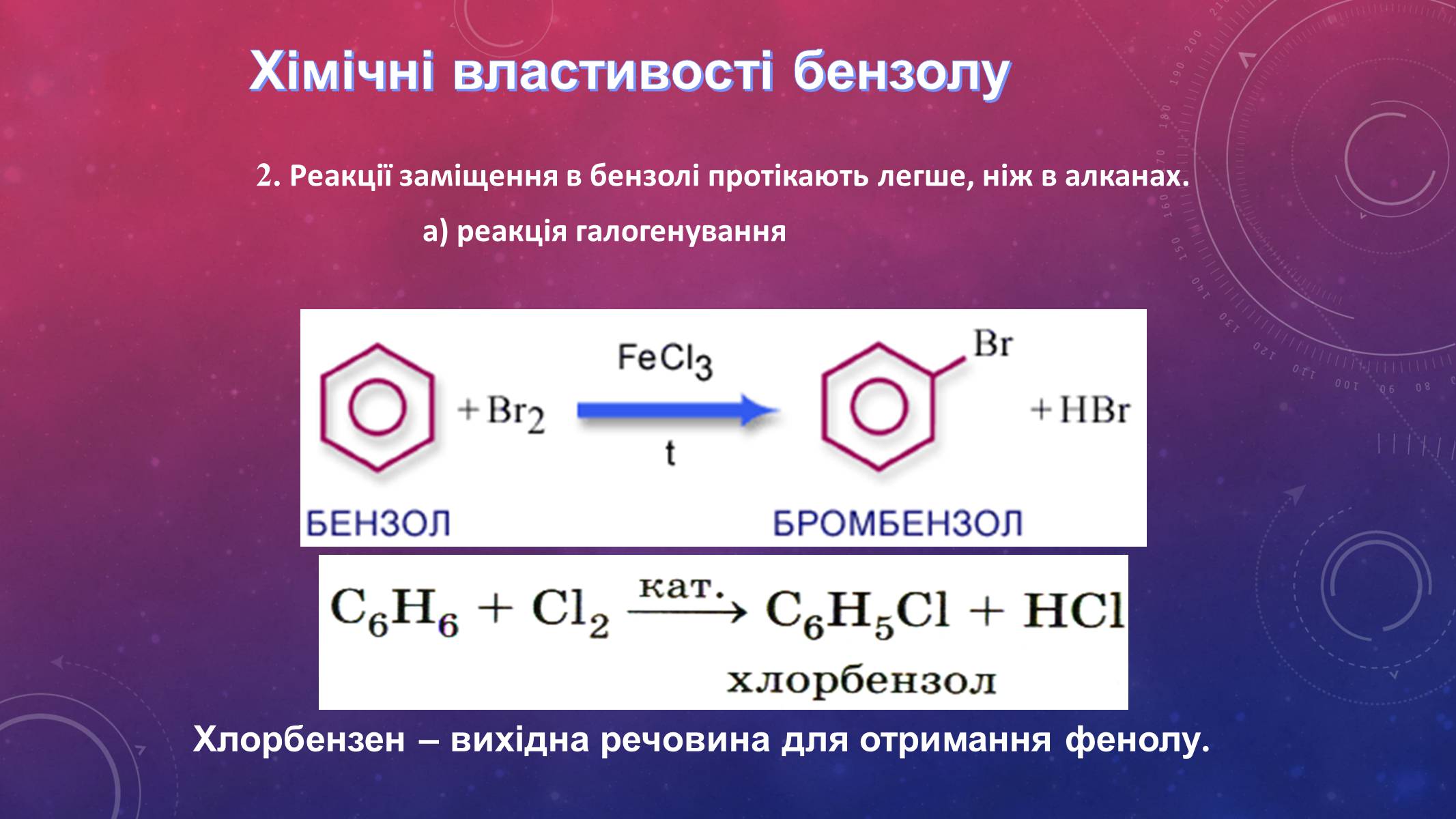
2. Реакції заміщення в бензолі протікають легше, ніж в алканах.
а) реакція галогенування
Хлорбензен – вихідна речовина для отримання фенолу.
2. Реакції заміщення в бензолі протікають легше, ніж в алканах.
а) реакція галогенування
Хлорбензен – вихідна речовина для отримання фенолу.
Слайд #17
Хімічні властивості бензолу
Незважаючи на високу ненасиченість молекули бензолу (за складом), він не дає характерних, якісних реакцій для ненасичених вуглеводнів: не знебарвлює бромну воду і розчин перманганату калію.
Це пов'язано з особливою будовою молекули бензолу.
Незважаючи на високу ненасиченість молекули бензолу (за складом), він не дає характерних, якісних реакцій для ненасичених вуглеводнів: не знебарвлює бромну воду і розчин перманганату калію.
Це пов'язано з особливою будовою молекули бензолу.
