- Головна
- Готові шкільні презентації
- Презентація на тему «Что такое фосфор»
Презентація на тему «Что такое фосфор»
278
Слайд #1
Что такое фосфор
История происхождения
Свойства и аллотропные изменения
Белый фосфор
Желтый фосфор
Красный фосфор
Чёрный фосфор
Фосфор в природе и его промышленная добыча
Применение
История происхождения
Свойства и аллотропные изменения
Белый фосфор
Желтый фосфор
Красный фосфор
Чёрный фосфор
Фосфор в природе и его промышленная добыча
Применение

Слайд #2
Проэкт
Фосфор
Выполнили ученики 10 классаБурдюк ,Власенко ,Черненко
Фосфор
Выполнили ученики 10 классаБурдюк ,Власенко ,Черненко

Слайд #3
Фосфор (P) – довольно распространённый химический элемент на нашей планете, но несмотря на это в природе в свободном виде практически не встречается. Всё дело в том, что фосфор обладает высокой химической активностью и вступает в реакции практически со всеми химическими элементами, образуя сто девяносто минералов, самым важным из которых является апатит. Своё название он получил от двух греческих слов – «свет» и «несу», то есть «светоносный». А вот латинское название этого элемента звучит как Phosphorus. Однако есть и ещё одна теория, по которой этот химический элемент получил своё название в честь Фосфора – стража Утренней звезды
Что такое «Фосфор»
Что такое «Фосфор»

Слайд #4
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать философский камень, а получил светящееся вещество. Бранд сфокусировался на опытах с человеческой мочой, так как полагал, что она, обладая золотистым цветом, может содержать золото или нечто нужное для добычи. Первоначально его способ заключался в том, что сначала моча отстаивалась в течение нескольких дней, пока не исчезнет неприятный запах, а затем кипятилась до клейкого состояния. Нагревая эту пасту до высоких температур и доводя до появления пузырьков, он надеялся, что, сконденсировавшись, они будут содержать золото. После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и к тому же мерцало в темноте. Бранд назвал это вещество phosphorus mirabilis (лат. «чудотворный носитель света»). Открытие фосфора Брандом стало первым открытием нового элемента со времён античности.
История происхождения
История происхождения

Слайд #5
Свойство простого вещества и промышленное получение фосфора. Вопрос
аллотропии фосфора сложен и до конца не решен. Обычно выделяют три
модификации простого вещества – белую, красную и черную. Иногда их ещё
называют главными аллотропными модификациями, Существует
аморфный фосфор различных цветов и оттенков – от ярко-красного до
фиолетового и коричневого.
Свойства
аллотропии фосфора сложен и до конца не решен. Обычно выделяют три
модификации простого вещества – белую, красную и черную. Иногда их ещё
называют главными аллотропными модификациями, Существует
аморфный фосфор различных цветов и оттенков – от ярко-красного до
фиолетового и коричневого.
Свойства

Слайд #6
Белый фосфор (P4), наиболее активная, летучая, форма простого вещества. В чистом виде это бесцветное стекловидное вещество, сильно преломляющее свет.
Обладает специфическим чесночным запахом.
Жирный на ощупь.
Мягкий ,легко режется ножом.
Температура плавления чистого вещества 44,1°С.
Температура кипения 280°С .
Плотность 1823 кг/м3 (293К).
Промышленный продукт может быть от соломенно- желтого до коричнево-красного или коричневого.
Практически нерастворим в воде(но растворим при комнатной температуре в неполярных органических растворителях:бензоле 3,7 г на 100 г C6H6), тетрахлорметане (1,27 г на 100 г CCl4), диэтиловом эфире (1,39 г на 100 г Et2O).Хорошими растворителями для него считаются жидкие аммиак и диоксид серы, а наилучшими – сероуглерод.)
Фосфор загорается в атмосфере хлора с образованием смеси хлоридов:
P4 +10Cl2 =4PCl3
P4 +10Cl2 =4PCl5
Белый фосфор довольно сильный восстановитель – вытесняет медь, свинец, ртуть и серебро из растворов солей(P4 +10CuSO4 +16H2O=4H3PO4 +10Cu+10H2SO4)Именно поэтому при отравлении белым фосфором рекомендуется выпить сильно разбавленный раствор медного купороса.
При слабом нагревании фосфор окисляется серой, а взаимодействие его с твердыми KClO3 , KMnO4 , KlO3 может приобретать взрывной характер.
В темноте можно наблюдать холодное зеленоватое свечение белого фосфора,
обусловленное протекающей разветвленной цепной реакцией окисления паров
фосфора.
Белый фосфор чрезвычайно ядовит, доза в 0,05-0,1 г смертельна для
человека. Он способен аккумулироваться в организме и вызывать некроз
костных тканей (особенно челюстей).
Белый фосфор
Обладает специфическим чесночным запахом.
Жирный на ощупь.
Мягкий ,легко режется ножом.
Температура плавления чистого вещества 44,1°С.
Температура кипения 280°С .
Плотность 1823 кг/м3 (293К).
Промышленный продукт может быть от соломенно- желтого до коричнево-красного или коричневого.
Практически нерастворим в воде(но растворим при комнатной температуре в неполярных органических растворителях:бензоле 3,7 г на 100 г C6H6), тетрахлорметане (1,27 г на 100 г CCl4), диэтиловом эфире (1,39 г на 100 г Et2O).Хорошими растворителями для него считаются жидкие аммиак и диоксид серы, а наилучшими – сероуглерод.)
Фосфор загорается в атмосфере хлора с образованием смеси хлоридов:
P4 +10Cl2 =4PCl3
P4 +10Cl2 =4PCl5
Белый фосфор довольно сильный восстановитель – вытесняет медь, свинец, ртуть и серебро из растворов солей(P4 +10CuSO4 +16H2O=4H3PO4 +10Cu+10H2SO4)Именно поэтому при отравлении белым фосфором рекомендуется выпить сильно разбавленный раствор медного купороса.
При слабом нагревании фосфор окисляется серой, а взаимодействие его с твердыми KClO3 , KMnO4 , KlO3 может приобретать взрывной характер.
В темноте можно наблюдать холодное зеленоватое свечение белого фосфора,
обусловленное протекающей разветвленной цепной реакцией окисления паров
фосфора.
Белый фосфор чрезвычайно ядовит, доза в 0,05-0,1 г смертельна для
человека. Он способен аккумулироваться в организме и вызывать некроз
костных тканей (особенно челюстей).
Белый фосфор

Слайд #7
Черный фосфор –Впервые получен в 1914 в виде кристаллической модификации высокой плотности (2690 кг/м3) американским физиком Перси Уильямом Бриджменом из белого фосфора при давлении 2·109 Па (20 тысяч атмосфер) и температура 200°С. Это черное полимерное вещество, нерастворимое ни в одном из растворителе. В отличие от белого фосфора черный фосфор практически невозможно поджечь. По некоторым своим характеристикам он напоминает графит, например, является проводником. Есть данные о существовании трех кристаллических модификаций черного фосфора. Кроме того описан аморфный черный фосфор. При температуре 220-230°С и давлении 13 000 атмосфер белый фосфор практически мгновенно превращается в черную кристаллическую форму. В более мягких условиях образуется аморфное вещество.
Чёрный фосфор
Чёрный фосфор

Слайд #8
Жёлтый фосфор – это тот же самый белый фосфор, но только не подвергшийся очистке. Сильно ядовит, огнеопасен, может воспламениться при контакте с воздухом, в воде не растворим. Именно поэтому в целях безопасности транспортируется в контейнерах под слоем воды
Жёлтый фосфор
Жёлтый фосфор

Слайд #9
Аморфный красный фосфор был открыт в 1847 в Швеции профессором химии Антоном Риттером фон Кристелли Шреттером – он нагревал белый фосфор в запаянной ампуле в атмосфере оксида углерода(II) при 500°С. Обычный продажный препарат грубодисперсен и окрашен в пурпурный цвет. Значения плотности красного фосфора, а в зависимости от способа получения, лежат в интервале 2000-240 кг/м3. По своей реакционной способности аморфный фосфор значительно уступает белому: воспламеняется при более высоких температурах, не светится в темноте, не взаимодействует с растворами Щелочей.Красный фосфор нелетуч, не растворяется ни в одном растворителе, а только в расплавах свинца и висмута. В отличии от белого он неядовит, во влажном воздухе постепенно окисляется с образованием смеси фосфорных кислот. Медленным окислением красного фосфора объясняется его кажущая Гидроскопичность. При кристаллизации фосфора из расплавленного свинца в 1865 немецкий физик Иоганн Вильгельм Гитторф получил кристаллы фиолетового фосфора (фосфор Гитторфа). Сейчас точно установлена его структура. На основании косвенных данных предполагают, что фосфор Гиттофа – крупнокристаллическая модификация красного фосфора.В результате нагревания любой модификации фосфора при атмосферном давлении получается пар, состоящий из тетраэдрических молекул P4. При температурах выше 800°С начинается заметная диссоциация тетрафосфора с образованием молекул P2. Степень дальнейшего распада с образованием атомного пара даже при температурах порядка 2000°С не превышает нескольких процентов. При конденсации паров фосфора или затвердевании его расплава всегда образуется метастабильная белая модификация.
Красный фосфор
Красный фосфор

Слайд #10
Химические Свойства Фосфора (Р)
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами :
Фосфор легко окисляется кислородом: 4P + 5O2 → 2P2O5 (с избытком кислорода), 4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды: 2P + 3Ca → Ca3P2, 2P + 3Mg → Mg3P2.
с неметаллами — восстановитель: 2P + 3S → P2S3, 2P + 3Cl2 → 2PCl3.
Не взаимодействует с водородом.
Взаимодействие с водой :
Взаимодействует с водой, при этом диспропорционирует: 4Р + 6Н2О → РН3 + 3Н3РО2 (фосфатная кислота).
Взаимодействие со щелочами :
В растворах щелочей диспропорционирование происходит в большей степени: 4Р + 3KOH + 3Н2О → РН3 + 3KН2РО2. Восстановительные свойства :
Сильные окислители превращают фосфор в фосфорную кислоту: 3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO; 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O.
Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль: 6P + 5KClO3 → 5KCl + 3P2O5
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами :
Фосфор легко окисляется кислородом: 4P + 5O2 → 2P2O5 (с избытком кислорода), 4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды: 2P + 3Ca → Ca3P2, 2P + 3Mg → Mg3P2.
с неметаллами — восстановитель: 2P + 3S → P2S3, 2P + 3Cl2 → 2PCl3.
Не взаимодействует с водородом.
Взаимодействие с водой :
Взаимодействует с водой, при этом диспропорционирует: 4Р + 6Н2О → РН3 + 3Н3РО2 (фосфатная кислота).
Взаимодействие со щелочами :
В растворах щелочей диспропорционирование происходит в большей степени: 4Р + 3KOH + 3Н2О → РН3 + 3KН2РО2. Восстановительные свойства :
Сильные окислители превращают фосфор в фосфорную кислоту: 3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO; 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O.
Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль: 6P + 5KClO3 → 5KCl + 3P2O5

Слайд #11
Фосфор в природе .Его промышленная добыча
Содержание фосфора в земной коре оценивается в 8 10-2% по массе. Фосфор – одиннадцатый по распространенности элемент на Земле и входит в двадцатку наиболее распространенных элементов Солнечной системы. Элемент №15 обнаружен во многих типах метеоритов и на луне. Например, в железных метеоритах содержание фосфора колеблется в диапазоне 0,02-0,94% (масс.), а в различных образцах лунного грунта оно составляет 0,05-0,32% (масс.) В свободном состоянии фосфор на земле не встречается и существует в литосфере почти в высшей степени окисления, в виде ортофосфат-иона PO45-. Известно более двухсот минералов, содержащих фосфор в значительных (более 1%) количествах.
Апатит (с др.-греч. ἀπατάω «обманываю») – минерал из группы фосфатов: фосфат кальция.
Химическая формула: Ca5[PO4]3(OH, F, Cl).
Блеск стеклянный, иногда жирноватый.
Очень хрупкий.
Удельный вес 3,2-3,4 г/см3
Цвет зеленый, голубовато-зеленый, синевато-зеленый, также бурый, голубой, фиолетовый, редко бесцветный, белый, иногда зеленый с серыми пятнами .
Растворяется в соляной и азотной кислотах. Солянокислый раствор при прибавлении аммиака дает белый студневидный осадок.
Гуано
Сильно разложившееся гуано состоит преимущественно из мометита CaHPO4 и витлокита b - Ca3(PO4)2
Содержание фосфора в земной коре оценивается в 8 10-2% по массе. Фосфор – одиннадцатый по распространенности элемент на Земле и входит в двадцатку наиболее распространенных элементов Солнечной системы. Элемент №15 обнаружен во многих типах метеоритов и на луне. Например, в железных метеоритах содержание фосфора колеблется в диапазоне 0,02-0,94% (масс.), а в различных образцах лунного грунта оно составляет 0,05-0,32% (масс.) В свободном состоянии фосфор на земле не встречается и существует в литосфере почти в высшей степени окисления, в виде ортофосфат-иона PO45-. Известно более двухсот минералов, содержащих фосфор в значительных (более 1%) количествах.
Апатит (с др.-греч. ἀπατάω «обманываю») – минерал из группы фосфатов: фосфат кальция.
Химическая формула: Ca5[PO4]3(OH, F, Cl).
Блеск стеклянный, иногда жирноватый.
Очень хрупкий.
Удельный вес 3,2-3,4 г/см3
Цвет зеленый, голубовато-зеленый, синевато-зеленый, также бурый, голубой, фиолетовый, редко бесцветный, белый, иногда зеленый с серыми пятнами .
Растворяется в соляной и азотной кислотах. Солянокислый раствор при прибавлении аммиака дает белый студневидный осадок.
Гуано
Сильно разложившееся гуано состоит преимущественно из мометита CaHPO4 и витлокита b - Ca3(PO4)2

Слайд #12
Обычно промышленным считается такое месторождение, которое дает не менее 6000 тонн фосфатной породы с 1 га. В открытых карьерах фосфат добывается скребковыми экскаваторами. Сначала удаляются наносы песков и пустая порода, а затем извлекают фосфатную руду. От карьеров до обогатительных фабрик руда может подаваться (на расстояния в несколько км) по стальным трубам в виде водной пульпы. морской воде весьма неорганический фосфор находится только в виде ортофосфат-аниона. Средняя концентрация фосфора в морской воде очень мала и составляет 0,07 мг3/литр. Высоко содержание фосфора в районе Андаманских островов (около 12 мкмоль/л). Общее океаническое количество фосфора оценивается в 9,8·1010 тонн
Использование в промышленности
Использование в промышленности
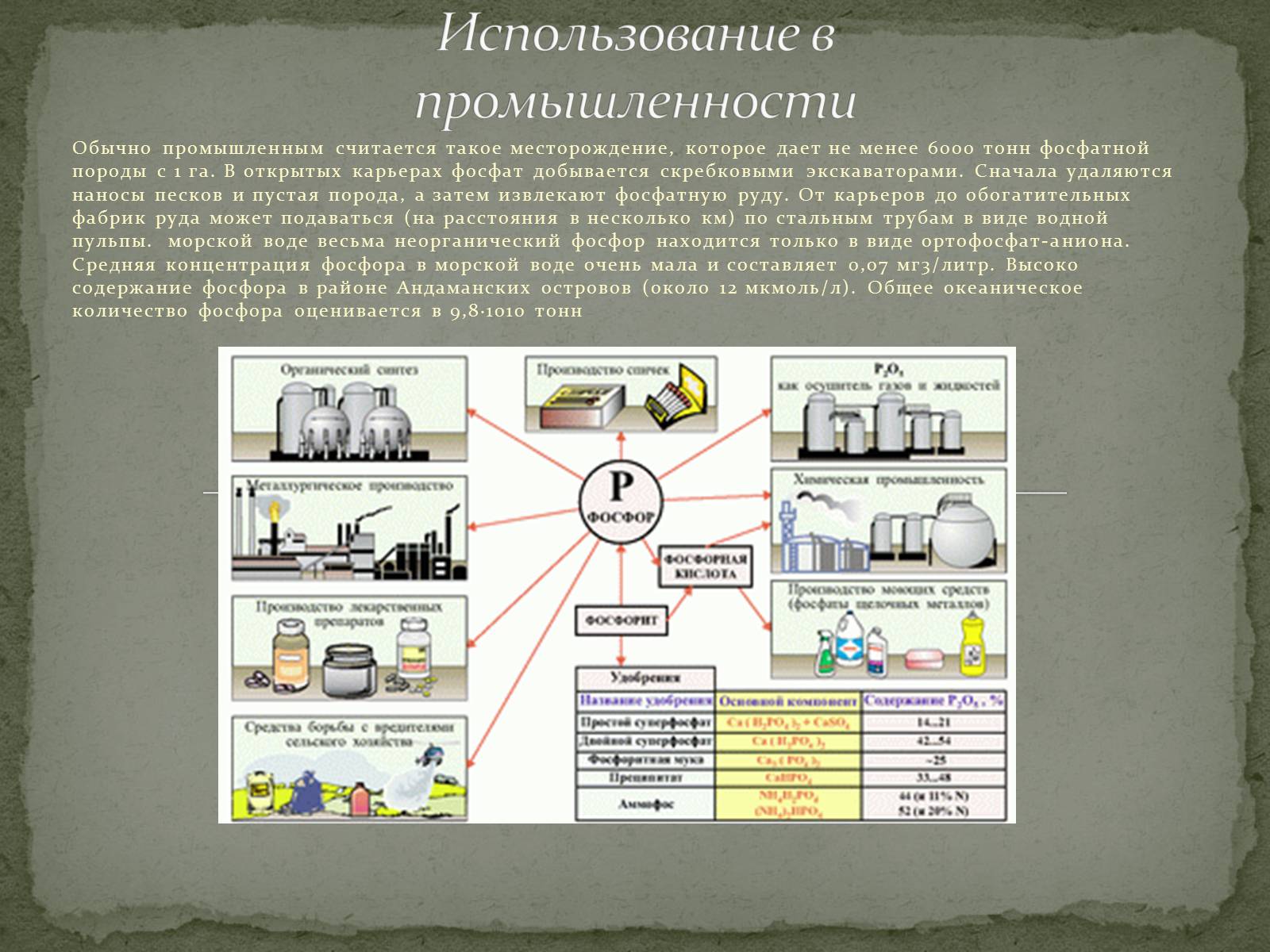
Слайд #13
Вследствие ядовитых свойств белого фосфора применение его ограничено; его используют, например, как отраву для грызунов и в фармацевтических препаратах.
Красный фосфор применяют в больших количествах при производстве спичек; светло-красный фосфор «Шенка» находит такое же применение. Далее, красный фосфор служит исходным продуктом для получения других соединений фосфора, например хлоридов, а также вкачестве галогенирующего агента, например, при получении бромистоводородной кислоты.
Из соединений фосфора наиболее важны фосфаты, прежде всего, в качестве удобрений. Если для обработки фосфата кальция вместо серной кислоты используют фосфорную, то в продукте реакции гипс не содержится и получается двойной суперфосфат.
Другое важное фосфорное удобрение — томасовая мука. Получается при тонком помоле томас-шлака − побочного продукта при производстве стали. Томасовая мука содержит фосфорную кислоту, хотя и не в растворимой форме, однако в такой, которая усваивается растениями, главным образом в виде двойной соли Са3(РО4)2 и Са2SiO4.
Из удобрений, наряду с фосфорной кислотой, содержащих также и азотистые соединения кроме гуано, следует упомянуть костяную муку, а также рыбную и мясную муку. Последние получают из отбросов при производстве рыбных консервов и т.д.
Применение
Красный фосфор применяют в больших количествах при производстве спичек; светло-красный фосфор «Шенка» находит такое же применение. Далее, красный фосфор служит исходным продуктом для получения других соединений фосфора, например хлоридов, а также вкачестве галогенирующего агента, например, при получении бромистоводородной кислоты.
Из соединений фосфора наиболее важны фосфаты, прежде всего, в качестве удобрений. Если для обработки фосфата кальция вместо серной кислоты используют фосфорную, то в продукте реакции гипс не содержится и получается двойной суперфосфат.
Другое важное фосфорное удобрение — томасовая мука. Получается при тонком помоле томас-шлака − побочного продукта при производстве стали. Томасовая мука содержит фосфорную кислоту, хотя и не в растворимой форме, однако в такой, которая усваивается растениями, главным образом в виде двойной соли Са3(РО4)2 и Са2SiO4.
Из удобрений, наряду с фосфорной кислотой, содержащих также и азотистые соединения кроме гуано, следует упомянуть костяную муку, а также рыбную и мясную муку. Последние получают из отбросов при производстве рыбных консервов и т.д.
Применение
