- Головна
- Готові шкільні презентації
- Презентація на тему «Сульфатна кислота» (варіант 1)
Презентація на тему «Сульфатна кислота» (варіант 1)
176
Слайд #1
Презентація на тему
Сульфатна кислота
Виконав
учень 10 класу
Драчук Микола
Сульфатна кислота
Виконав
учень 10 класу
Драчук Микола

Слайд #2
Сульфатна кислота (Застаріла назва — купоросне масло) — сполука сірки з формулою H2SO4.Безбарвна масляниста,дуже в'язка і гігроскопічна рідина.Сірчана кислота одна з найсильніших неорганічних кислот і є дуже їдкою та небезпечною.Ця кислота утворює два ряди солей: сульфати і гідрогенсульфати, в яких у порівнянні з сульфатною кислотою замінюються один або два аніони гідрогену на катіони металів.Сірчана кислота є однією з найважливіших технічних речовин у світі і лідирує за кількостю виробництва.Вона в основному використовується для виробництва добрив і інших неорганічних кислот.В основному використовуються водні розчини цієї кислоти.

Слайд #3
Вільна сірчана кислота зустрічається в природі дуже рідко. В атмосфері вона утворюється з діоксиду сірки, який утворюється при згоранні сірковмісних речовин або вулканічних вивержень. Діоксид сірки окислюється гідроксильними радикалами та киснем з утворенням триоксиду сірки, який вступаючи в реакцію з атмосферною вологою утворює кислоту. У кислотних дощах вона виступає в розбавленому виді. Невелику кількість вільної сірчаної кислоти також можна знайти в деяких вулканічних джерелах, які називаються сольфатари. Найбільшу кількість сірчаної кислоти у світі містить озеро в кратері вулкана Іджен в Індонезії. На відміну від вільної кислоти, її солі, зокрема, сульфати, зустрічається в природі набагато частіше. Існує багато різних мінералів сульфатів. Серед них найвідомішими й найважливішими є гіпс (CaSO4 · 2 H2O), барит (BaSO4), Халькантит (CuSO4 · 5 H2O) і глауберова сіль (Na2SO4 · 10 H2O).

Слайд #4
Сировиною для виробництва сірчаної кислоти є елементарна сірка яку отримують в величезних кільскостях на нафто- та газовопереробних заводах, з сірководню, за допомогою процесу, який відомий як процес Клауса.Потім сірку оксилюють до діоксиду сірки:
Реакція сірки з киснем
Ще одним джерелом діоксиду сірки є виплавлення руд, що містять сірку. Прикладами є мідні, цинкові і свинцові сульфіди. Діоксид сірки утворюється при випаленні з киснем повітря.
Реакція під час випалу сульфіду цинку
У 1999 році в Європі було випалено близько 3 млн. тонн піриту для виробництва сульфатноъ кислоти. В Азії ця цифра більша,оскільки і запаси його більші.[4] Для бідних ресурсами країнах, які не мають ні сірки, ні сульфідних руд, існує процес Мюллера-Кюне. В цьому процесі діоксид сірки утворюється при випаленні гіпсу і вугілля в печі. Цей процес можна зробити прибутковішим, якщо в піч додавати пісок і глину для утворення цементу як побічного продукту.Для подальшого виробництва потребується сірчаний ангідрид. Прямої реакції діоксиду сірки і кисню в триоксид сірки не існує, так як рівновага лежить на стороні триоксида сірки. Тому для проведення цієї реакції потрібні каталізатори.
Окиснення діоксиду сірки до триоксиду
Триоксид сірки не розбавляється у воді відразу ж. Спочатку його вводять у концентровану сірчану кислоту,цей розчин називають - олеумом. Потім олеум розчиняють у воді до утворення сірчаної кислоти.
Розчинення сірчаного ангідриту в концентрованій сірчаній кислоті з утворення дисульфатної кислоти
Розчинення дисульфатної кислоти у воді
В останні роки виробництво сірчаної кислоти зросло в основному в Китаї, у той час як в європейських країнах, виробництво скоротилося.
Реакція сірки з киснем
Ще одним джерелом діоксиду сірки є виплавлення руд, що містять сірку. Прикладами є мідні, цинкові і свинцові сульфіди. Діоксид сірки утворюється при випаленні з киснем повітря.
Реакція під час випалу сульфіду цинку
У 1999 році в Європі було випалено близько 3 млн. тонн піриту для виробництва сульфатноъ кислоти. В Азії ця цифра більша,оскільки і запаси його більші.[4] Для бідних ресурсами країнах, які не мають ні сірки, ні сульфідних руд, існує процес Мюллера-Кюне. В цьому процесі діоксид сірки утворюється при випаленні гіпсу і вугілля в печі. Цей процес можна зробити прибутковішим, якщо в піч додавати пісок і глину для утворення цементу як побічного продукту.Для подальшого виробництва потребується сірчаний ангідрид. Прямої реакції діоксиду сірки і кисню в триоксид сірки не існує, так як рівновага лежить на стороні триоксида сірки. Тому для проведення цієї реакції потрібні каталізатори.
Окиснення діоксиду сірки до триоксиду
Триоксид сірки не розбавляється у воді відразу ж. Спочатку його вводять у концентровану сірчану кислоту,цей розчин називають - олеумом. Потім олеум розчиняють у воді до утворення сірчаної кислоти.
Розчинення сірчаного ангідриту в концентрованій сірчаній кислоті з утворення дисульфатної кислоти
Розчинення дисульфатної кислоти у воді
В останні роки виробництво сірчаної кислоти зросло в основному в Китаї, у той час як в європейських країнах, виробництво скоротилося.

Слайд #5
Дисоціація у водному розчині йде в декілька етапів:
Сульфатна кислота руйнує також багато органічних речовин, зокрема вуглеводи — дерево, папір, бавовняні тканини, цукор тощо. Руйнування цих речовин обумовлюється тим, що концентрована сульфатна кислота віднімає від них водень і кисень у вигляді води, а вуглець залишається у вигляді пористого вугілля. При дії розведеної сульфатної кислоти на метали, які у електрохімічному ряді активності металів розташовані ліворуч водню, виділяється водень. Концентрована сірчана кислота має сильний окислювальний ефект і здатна реагувати, при нагріванні, навіть з благородними металами, такими як мідь, ртуть і срібло, хоча при цьому вона не взаємодіє з залізом. Тому для перевезення концентрованої сульфатної кислоти використовуються залізні цистерни.
Сульфатна кислота руйнує також багато органічних речовин, зокрема вуглеводи — дерево, папір, бавовняні тканини, цукор тощо. Руйнування цих речовин обумовлюється тим, що концентрована сульфатна кислота віднімає від них водень і кисень у вигляді води, а вуглець залишається у вигляді пористого вугілля. При дії розведеної сульфатної кислоти на метали, які у електрохімічному ряді активності металів розташовані ліворуч водню, виділяється водень. Концентрована сірчана кислота має сильний окислювальний ефект і здатна реагувати, при нагріванні, навіть з благородними металами, такими як мідь, ртуть і срібло, хоча при цьому вона не взаємодіє з залізом. Тому для перевезення концентрованої сульфатної кислоти використовуються залізні цистерни.

Слайд #6
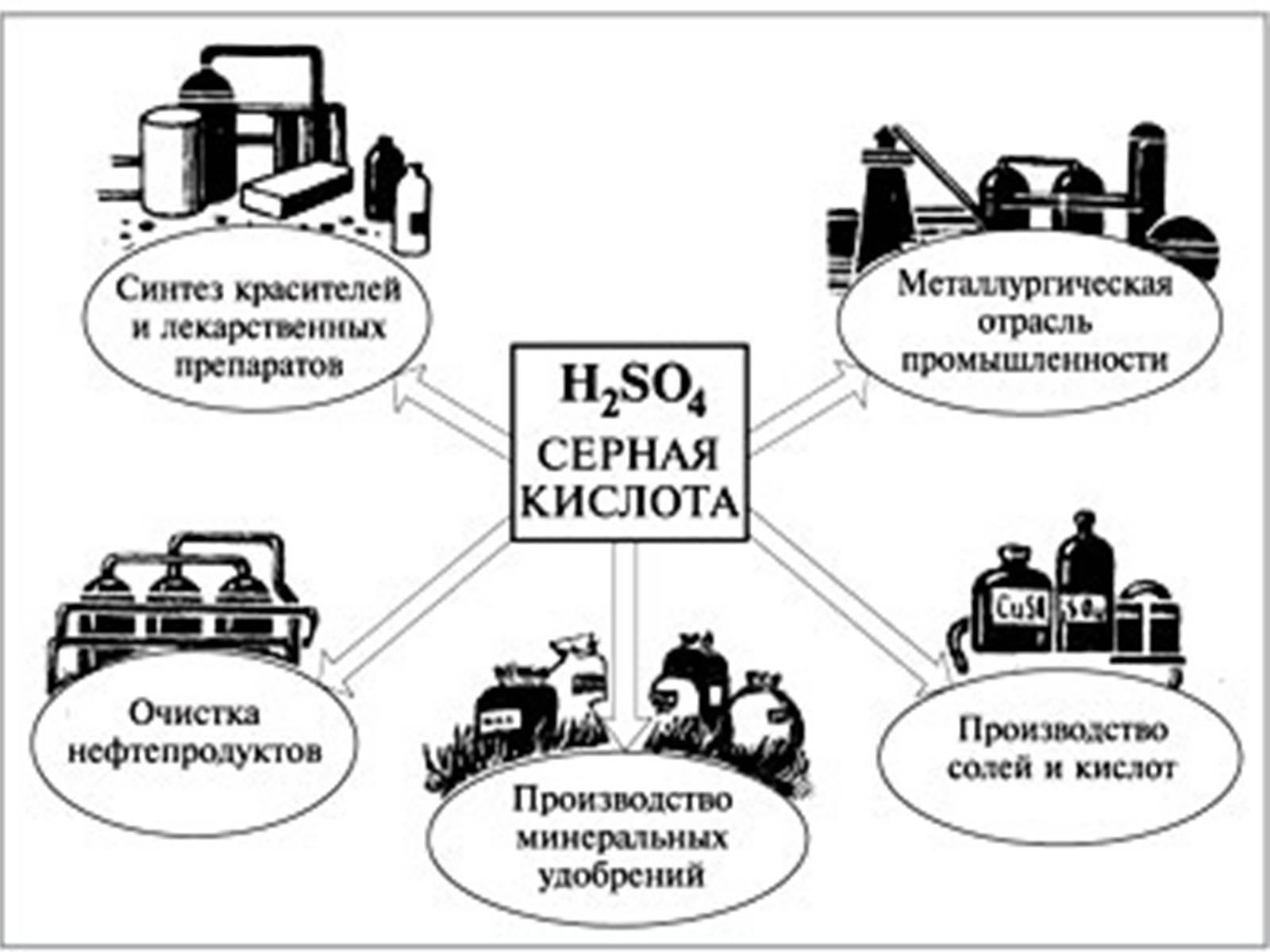
Сірчана кислота є дуже важливим товаром хімічної промисловості і є індикатором її промислової потужності. Світове виробництво в 2004 році склало близько 180 млн. тонн, при наступному географічному розподілі: Азія 35%, Північна Америка 24%, Африка 11%, Західна Європа 10%, Східна Європа і Росія 10%, Австралія і Океанія 7%, Південна Америка 7%.[6] Більша частина виробленої кислоти (~ 60%) витрачається на виробництво добрив, суперфосфату фосфату амонію,сульфатів, сульфату амонію. Близько 20% використовується в хімічній промисловості для виробництва миючих засобів, синтетичних смол, барвників, фармацевтичних препаратів, інсектицидів, антифризу, а також для різних технічних процесів. Близько 6% використовують для виробництва пігментів, фарб, емалей, типографських фарб. Використовується також як осушувач газів.

Слайд #7
Сірчана кислота є дуже важливим товаром хімічної промисловості і є індикатором її промислової потужності. Світове виробництво в 2004 році склало близько 180 млн. тонн, при наступному географічному розподілі: Азія 35%, Північна Америка 24%, Африка 11%, Західна Європа 10%, Східна Європа і Росія 10%, Австралія і Океанія 7%, Південна Америка 7%.[6] Більша частина виробленої кислоти (~ 60%) витрачається на виробництво добрив, суперфосфату фосфату амонію,сульфатів, сульфату амонію. Близько 20% використовується в хімічній промисловості для виробництва миючих засобів, синтетичних смол, барвників, фармацевтичних препаратів, інсектицидів, антифризу, а також для різних технічних процесів. Близько 6% використовують для виробництва пігментів, фарб, емалей, типографських фарб. Використовується також як осушувач газів.
Слайд #8
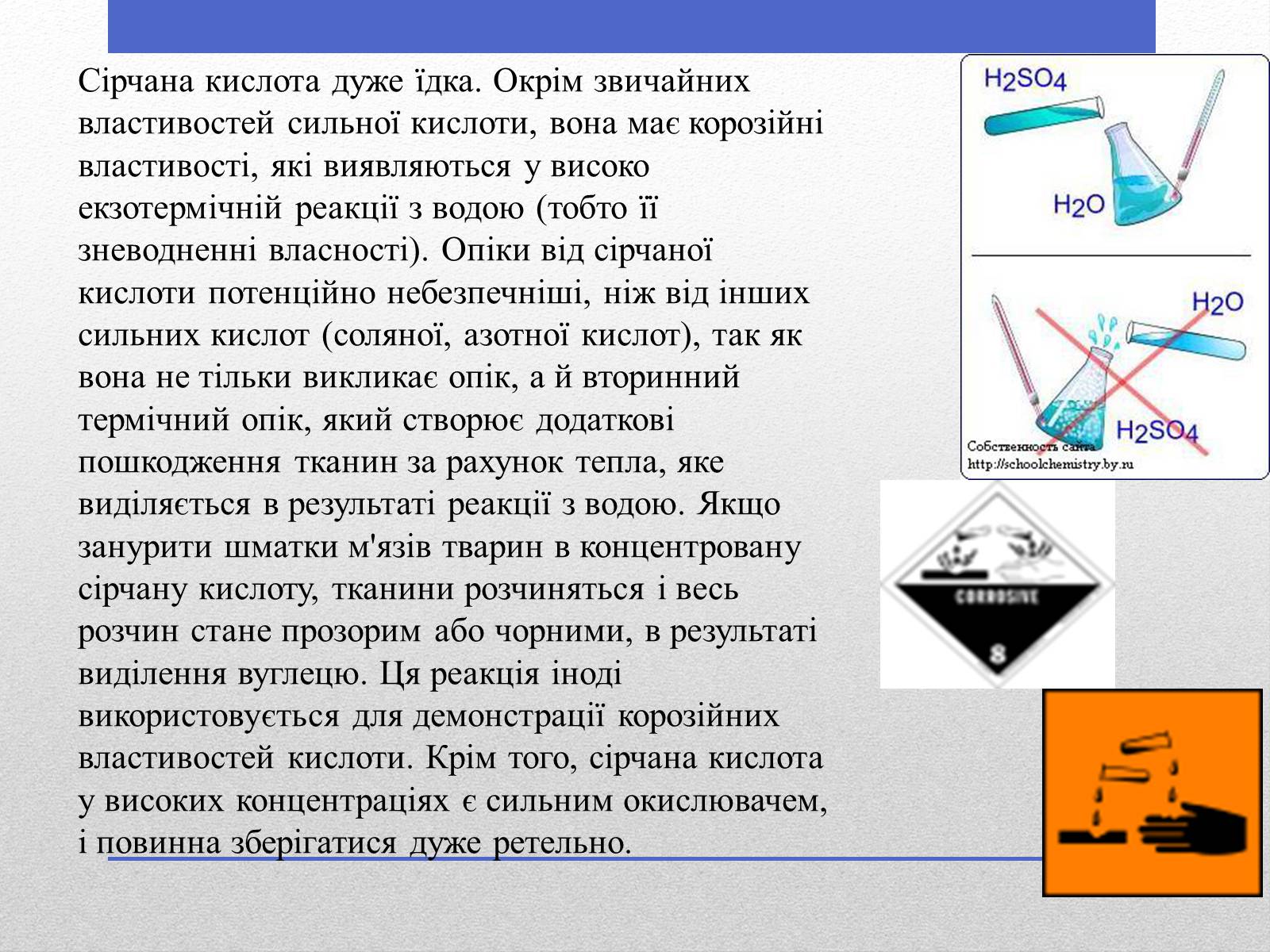
Сірчана кислота дуже їдка. Окрім звичайних властивостей сильної кислоти, вона має корозійні властивості, які виявляються у високо екзотермічній реакції з водою (тобто її зневодненні власності). Опіки від сірчаної кислоти потенційно небезпечніші, ніж від інших сильних кислот (соляної, азотної кислот), так як вона не тільки викликає опік, а й вторинний термічний опік, який створює додаткові пошкодження тканин за рахунок тепла, яке виділяється в результаті реакції з водою. Якщо занурити шматки м'язів тварин в концентровану сірчану кислоту, тканини розчиняться і весь розчин стане прозорим або чорними, в результаті виділення вуглецю. Ця реакція іноді використовується для демонстрації корозійних властивостей кислоти. Крім того, сірчана кислота у високих концентраціях є сильним окислювачем, і повинна зберігатися дуже ретельно.
Слайд #9
The End
