- Головна
- Готові шкільні презентації
- Презентація на тему «Алюміній» (варіант 5)
Презентація на тему «Алюміній» (варіант 5)
377
Слайд #1
Алюміній

Слайд #2
Його назва походить від латинського слова,що в перекладі на нашу-галун,назва подвійної солі,до складу якої входить алюміній
Алюміній Al один із «лідерів» серед всіх хімічних елементів Землі. Алюмінію в земній корі майже 8%; його випереджають за розповсюдженням лише кисень та силіцій. Але добути цей метал вдалося зовсім недавно, менш ніж два сторіччя тому. З того часу він став широко використовуватися в електротехніці, будівництві, авіації.
Алюміній Al один із «лідерів» серед всіх хімічних елементів Землі. Алюмінію в земній корі майже 8%; його випереджають за розповсюдженням лише кисень та силіцій. Але добути цей метал вдалося зовсім недавно, менш ніж два сторіччя тому. З того часу він став широко використовуватися в електротехніці, будівництві, авіації.

Слайд #3
Порядковий номер:
13
Група:
III,головна
Период:
3
Електронна конфігурація:
3s2 3p1
Атомна маса:
26,98154
Температура плавленя:
660,37С; 1220.67F
Температура кипіння:
2519С; 4566.2F
Густина(г/см3):
2,702
Ступінь окиснення
+3
Колір елемента:
срібний
Був відкритий:
Гансом Крістіаном Эрстедом
Рік відкриття :
1825
Країна відкриття:
Дания
13
Група:
III,головна
Период:
3
Електронна конфігурація:
3s2 3p1
Атомна маса:
26,98154
Температура плавленя:
660,37С; 1220.67F
Температура кипіння:
2519С; 4566.2F
Густина(г/см3):
2,702
Ступінь окиснення
+3
Колір елемента:
срібний
Був відкритий:
Гансом Крістіаном Эрстедом
Рік відкриття :
1825
Країна відкриття:
Дания

Слайд #4
Поширеність в природі
Алюміній-третій елемент за поширенням у природі після Оксигену і Силіцію:його атомна частка в корі в земній корі становить 6,4%. Трапляється в складі сполук,переважно алюмосилікатів
Боксит
Нефелін
Кріоліт
Каолініт
Польовий шпат
Основні природні сполуки Алюмінію:
1. Нефеліни — (Na,K)2О • АlО3 • 2Si2.2. Кріоліт — А1F3 • 3NaF3. Боксити — алюмінієва руда Аl2O3 • хH2O .4. Каолін — А12О3 • 2SiO2 • 2Н2О.5. Глиноземи — суміш каоліну з піском SiO2, вапняком СаСО3, магнезитом МgСО3.
Алюміній-третій елемент за поширенням у природі після Оксигену і Силіцію:його атомна частка в корі в земній корі становить 6,4%. Трапляється в складі сполук,переважно алюмосилікатів
Боксит
Нефелін
Кріоліт
Каолініт
Польовий шпат
Основні природні сполуки Алюмінію:
1. Нефеліни — (Na,K)2О • АlО3 • 2Si2.2. Кріоліт — А1F3 • 3NaF3. Боксити — алюмінієва руда Аl2O3 • хH2O .4. Каолін — А12О3 • 2SiO2 • 2Н2О.5. Глиноземи — суміш каоліну з піском SiO2, вапняком СаСО3, магнезитом МgСО3.

Слайд #5
Боксит
Нефелін
Кріоліт
Каолініт
Польовий шпат
Нефелін
Кріоліт
Каолініт
Польовий шпат

Слайд #6
Фізичні властивості Алюмінію:Алюміній – сріблясто-білий метал, легкий і пластичний, густина його = 2,7 г/см3, температура плавлення = 660 0С. Легко витягується в дріт, прокочується у фольгу. За електропровідністю поступається лише сріблу й міді. Входить до складу легких сплавів.

Слайд #7
Хімічні властивості лужних металів.
Взаємодія з неметалами:
1) З киснем:
4Аl + 3О2 = 2Аl2О3
2) З галогенами:2Аl + ЗВr2 = 2АlВr3
3) З іншими неметалами при підвищенні температури:
2Аl + 3S = Аl2S3 (сульфід алюмінію)2Аl + N2 = 2АlN (нітрид алюмінію)4Аl + 3С = А14С3 (карбід алюмінію)
Алюмотермія: 2Аl + 3W3 = 3W + А12О3
Взаємодія з водою після зняття оксидної плівки:
2Аl + 6Н2О = 2Аl(ОН)3 + ЗН2
Після зняття оксидної плівки Алюміній розчиняється в лугах:
2Аl + 2NаОН + 2Н2О = 2NаАlО2 + 3Н2
Розчиняється в розведених кислотах:
2А1 + 6НС1 = 2АlСl3 + ЗН22А1 + ЗН2SО4 = Аl2(S04)3 + 3Н2
Алюміній пасивується при взаємодії з концентрованою нітратною кислотою, тому з нею Алюміній взаємодіє лише при нагріванні:
Аl + 6НNO3(конц.) = Аl(NО3)3 + 3NО2 + 3Н2О
Взаємодія з неметалами:
1) З киснем:
4Аl + 3О2 = 2Аl2О3
2) З галогенами:2Аl + ЗВr2 = 2АlВr3
3) З іншими неметалами при підвищенні температури:
2Аl + 3S = Аl2S3 (сульфід алюмінію)2Аl + N2 = 2АlN (нітрид алюмінію)4Аl + 3С = А14С3 (карбід алюмінію)
Алюмотермія: 2Аl + 3W3 = 3W + А12О3
Взаємодія з водою після зняття оксидної плівки:
2Аl + 6Н2О = 2Аl(ОН)3 + ЗН2
Після зняття оксидної плівки Алюміній розчиняється в лугах:
2Аl + 2NаОН + 2Н2О = 2NаАlО2 + 3Н2
Розчиняється в розведених кислотах:
2А1 + 6НС1 = 2АlСl3 + ЗН22А1 + ЗН2SО4 = Аl2(S04)3 + 3Н2
Алюміній пасивується при взаємодії з концентрованою нітратною кислотою, тому з нею Алюміній взаємодіє лише при нагріванні:
Аl + 6НNO3(конц.) = Аl(NО3)3 + 3NО2 + 3Н2О

Слайд #8
Алюміній оксид Аl 2O3
Проявляє амфотерні властивості:
Аl2O3 +6 НС1 = 2АlСl3 + 3Н2О
Аl 2O3 + 2NаОН + 3Н2О = 2 Na[Al(OH)4] – у розчинах
Аl 2O3 + 2NаОН = 2NaAlO2 + Н2О – у процесі сплавлення
Проявляє амфотерні властивості:
Аl2O3 +6 НС1 = 2АlСl3 + 3Н2О
Аl 2O3 + 2NаОН + 3Н2О = 2 Na[Al(OH)4] – у розчинах
Аl 2O3 + 2NаОН = 2NaAlO2 + Н2О – у процесі сплавлення

Слайд #9
Алюміній гідроксид Al(OH)3
Проявляє амфотерні властивості:
Аl (OH)3 + 3НС1 = АlСl3 + 3Н2О
Аl (OH)3 + NаОН = Na[Al(OH)4] – у розчинах
2Аl (OH)3 + Nа2О = 2NaAlO2 + 3 Н2О – у розплаві
Проявляє амфотерні властивості:
Аl (OH)3 + 3НС1 = АlСl3 + 3Н2О
Аl (OH)3 + NаОН = Na[Al(OH)4] – у розчинах
2Аl (OH)3 + Nа2О = 2NaAlO2 + 3 Н2О – у розплаві

Слайд #10
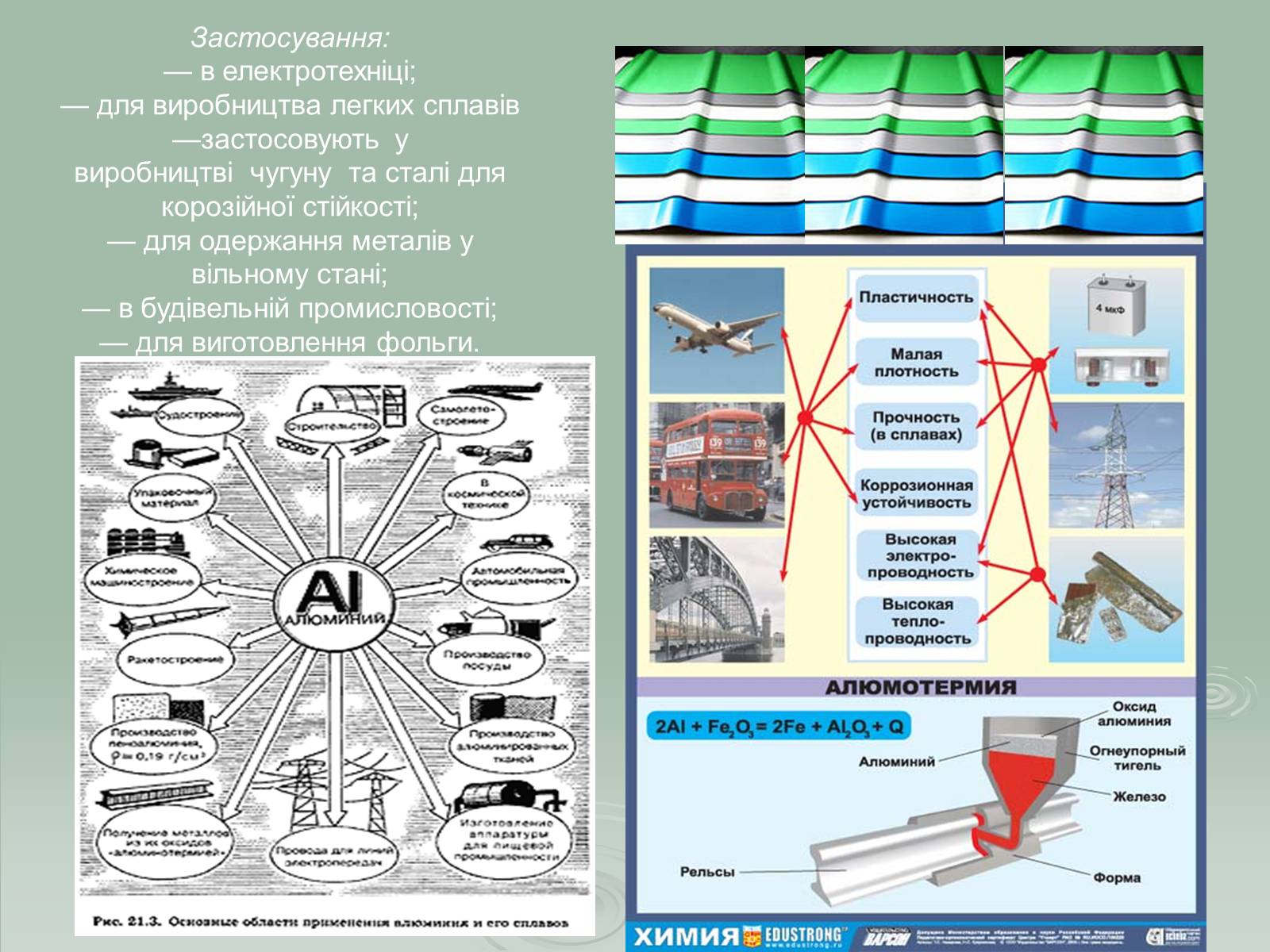
Застосування:
— в електротехніці;— для виробництва легких сплавів—застосовують у виробництві чугуну та сталі для корозійної стійкості;— для одержання металів у вільному стані;— в будівельній промисловості;— для виготовлення фольги.
— в електротехніці;— для виробництва легких сплавів—застосовують у виробництві чугуну та сталі для корозійної стійкості;— для одержання металів у вільному стані;— в будівельній промисловості;— для виготовлення фольги.
Слайд #11
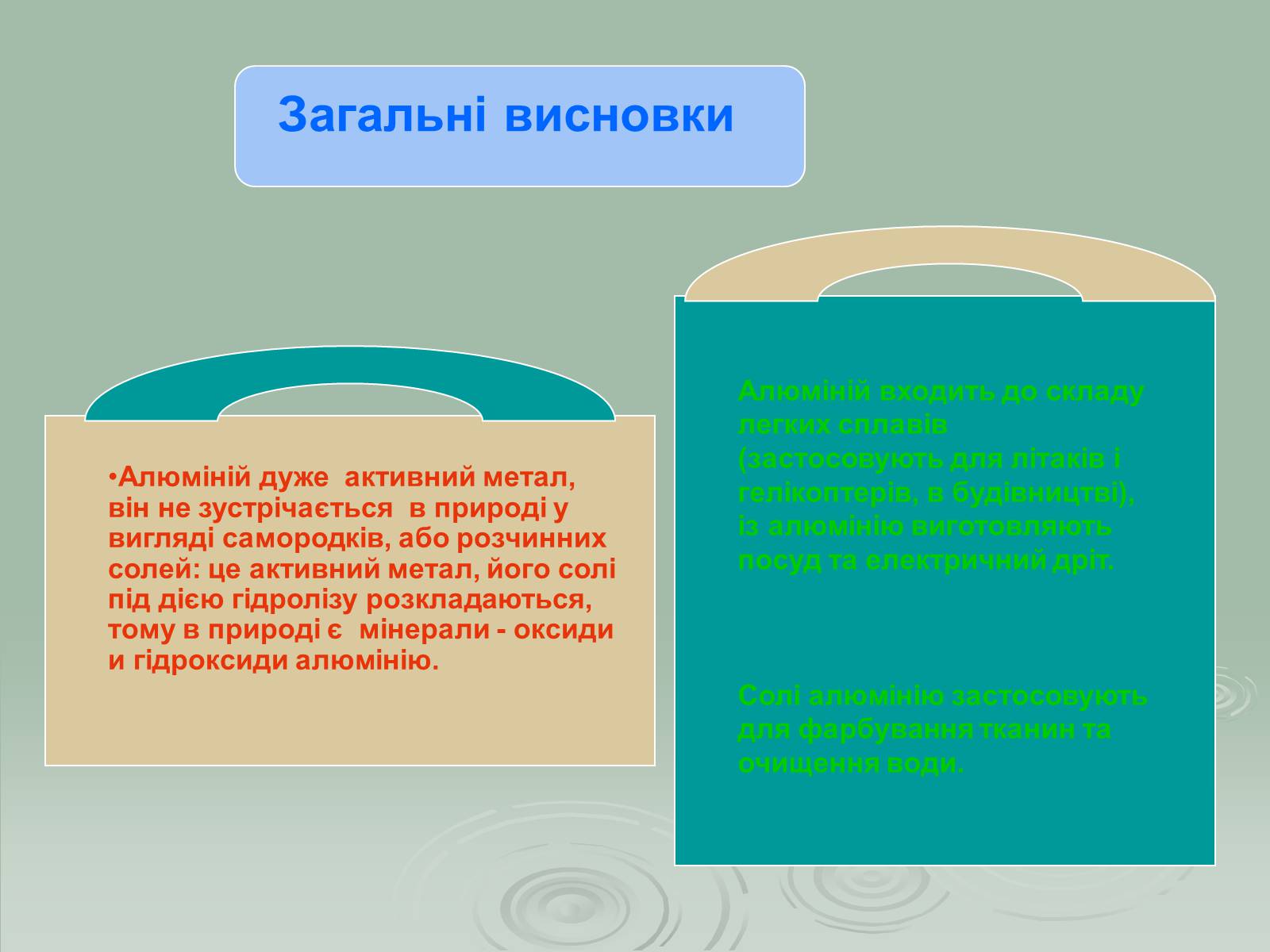
Алюміній дуже активний метал, він не зустрічається в природі у вигляді самородків, або розчинних солей: це активний метал, його солі під дією гідролізу розкладаються, тому в природі є мінерали - оксиди и гідроксиди алюмінію.
Алюміній входить до складу легких сплавів (застосовують для літаків і гелікоптерів, в будівництві), із алюмінію виготовляють посуд та електричний дріт.
Солі алюмінію застосовують для фарбування тканин та очищення води.
Загальні висновки
Алюміній входить до складу легких сплавів (застосовують для літаків і гелікоптерів, в будівництві), із алюмінію виготовляють посуд та електричний дріт.
Солі алюмінію застосовують для фарбування тканин та очищення води.
Загальні висновки