- Головна
- Готові шкільні презентації
- Презентація на тему «Біологічна роль білків»
Презентація на тему «Біологічна роль білків»
545
Слайд #1
Біологічна роль білків

Слайд #2
Білки - високомолекулярні органічні сполуки, які складаються зі сполучених у ланцюг амінокислотних залишків. Унаслідок гідролізу руйнуються пептидні зв'язки між амінокислотними залишками. Реакція гідролізу білків обернена до реакції їхнього утворення з амінокислот.
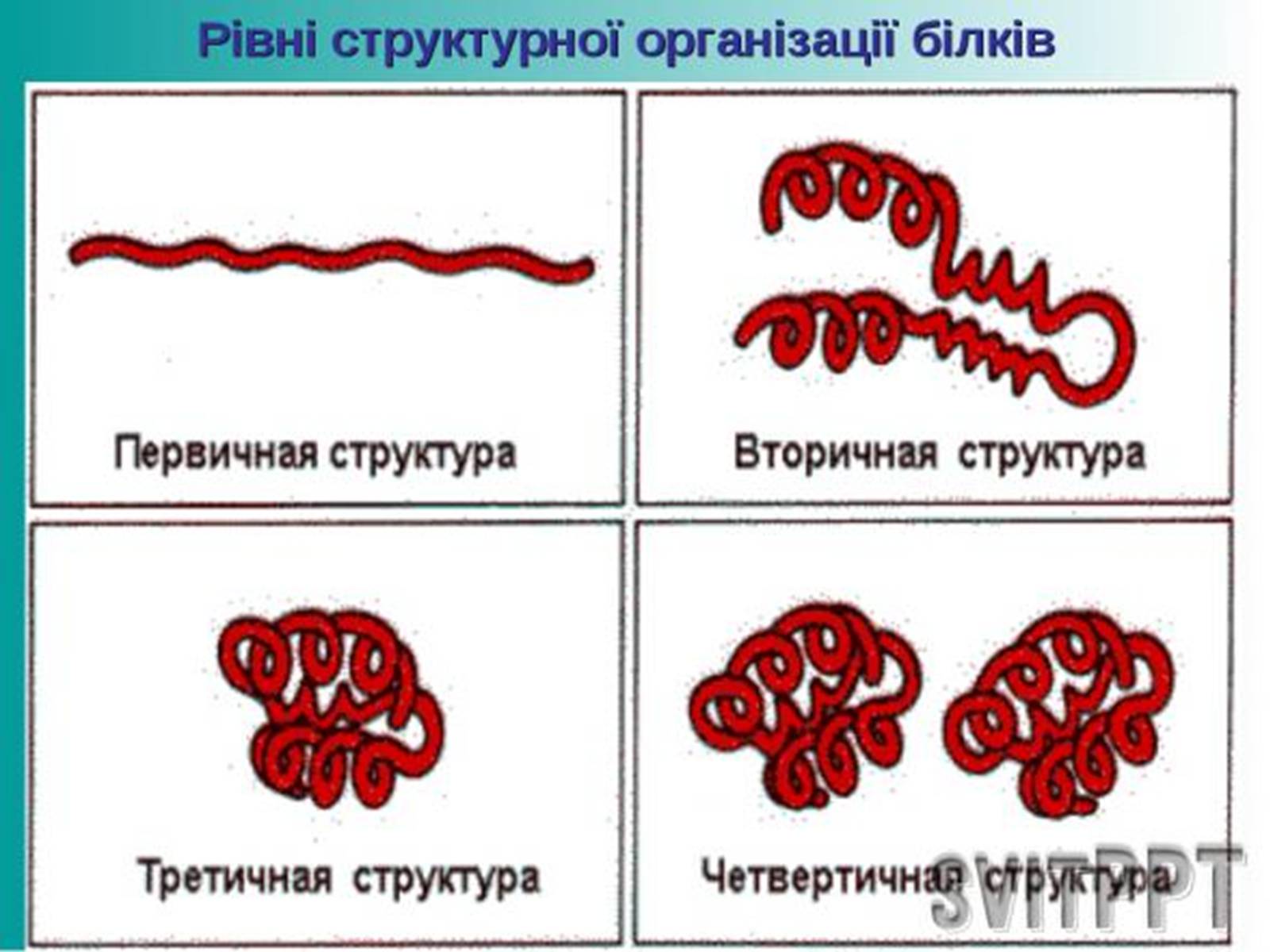
Рівні організації білкової молекули - її первинна, вторинна, третинна й четвертинна структури. Первинна структура - послідовність амінокислотних залишків у поліпептидному ланцюзі. Первинна структура білка виникає внаслідок утворення пептидних зв'язків між амінокислотними залишками. Вторинна структура - місцеве впорядкування фрагмента поліпептидного ланцюга внаслідок утворення водневих зв'язків. Третинна структура - просторова будова поліпептидного ланцюга, зумовлена взаємним розташуванням елементів вторинної структури. Третинна структура стабілізована насамперед ковалентними зв'язками, які виникають унаслідок взаємодії між функціональними групами різної хімічної природи. Четвертинна структура зумовлена взаємним розташуванням кількох поліпептидних ланцюгів у складі єдиного білкового.
Рівні організації білкової молекули - її первинна, вторинна, третинна й четвертинна структури. Первинна структура - послідовність амінокислотних залишків у поліпептидному ланцюзі. Первинна структура білка виникає внаслідок утворення пептидних зв'язків між амінокислотними залишками. Вторинна структура - місцеве впорядкування фрагмента поліпептидного ланцюга внаслідок утворення водневих зв'язків. Третинна структура - просторова будова поліпептидного ланцюга, зумовлена взаємним розташуванням елементів вторинної структури. Третинна структура стабілізована насамперед ковалентними зв'язками, які виникають унаслідок взаємодії між функціональними групами різної хімічної природи. Четвертинна структура зумовлена взаємним розташуванням кількох поліпептидних ланцюгів у складі єдиного білкового.

Слайд #3
Білки - високомолекулярні органічні сполуки, які складаються зі сполучених у ланцюг амінокислотних залишків. Унаслідок гідролізу руйнуються пептидні зв'язки між амінокислотними залишками. Реакція гідролізу білків обернена до реакції їхнього утворення з амінокислот.
Рівні організації білкової молекули - її первинна, вторинна, третинна й четвертинна структури. Первинна структура - послідовність амінокислотних залишків у поліпептидному ланцюзі. Первинна структура білка виникає внаслідок утворення пептидних зв'язків між амінокислотними залишками. Вторинна структура - місцеве впорядкування фрагмента поліпептидного ланцюга внаслідок утворення водневих зв'язків. Третинна структура - просторова будова поліпептидного ланцюга, зумовлена взаємним розташуванням елементів вторинної структури. Третинна структура стабілізована насамперед ковалентними зв'язками, які виникають унаслідок взаємодії між функціональними групами різної хімічної природи. Четвертинна структура зумовлена взаємним розташуванням кількох поліпептидних ланцюгів у складі єдиного білкового.
Рівні організації білкової молекули - її первинна, вторинна, третинна й четвертинна структури. Первинна структура - послідовність амінокислотних залишків у поліпептидному ланцюзі. Первинна структура білка виникає внаслідок утворення пептидних зв'язків між амінокислотними залишками. Вторинна структура - місцеве впорядкування фрагмента поліпептидного ланцюга внаслідок утворення водневих зв'язків. Третинна структура - просторова будова поліпептидного ланцюга, зумовлена взаємним розташуванням елементів вторинної структури. Третинна структура стабілізована насамперед ковалентними зв'язками, які виникають унаслідок взаємодії між функціональними групами різної хімічної природи. Четвертинна структура зумовлена взаємним розташуванням кількох поліпептидних ланцюгів у складі єдиного білкового.
Слайд #4
Чи розчинні білки? Це залежить від їхньої будови: саме просторова структура білка визначає його властивості й біологічні функції.
У молекулах глобулярних білків поліпептидні ланцюги згорнуті в щільні кулясті структури - глобули. До глобулярних білків належать ферменти, антитіла, деякі гормони тощо. Чимало глобулярних білків - водорозчинні, зокрема альбуміни, - прості глобулярні білки, які містяться в яєчному білку, сироватці крові, молоці й насінні рослин.
Білки, що входять до складу покривних тканин і утворень, - фібрилярні (мал. 35.6). Вони погано розчинні або нерозчинні у воді. Це білки м'язових тканин, шкірних рогових покривів, вовни й пір'я тощо.
У молекулах глобулярних білків поліпептидні ланцюги згорнуті в щільні кулясті структури - глобули. До глобулярних білків належать ферменти, антитіла, деякі гормони тощо. Чимало глобулярних білків - водорозчинні, зокрема альбуміни, - прості глобулярні білки, які містяться в яєчному білку, сироватці крові, молоці й насінні рослин.
Білки, що входять до складу покривних тканин і утворень, - фібрилярні (мал. 35.6). Вони погано розчинні або нерозчинні у воді. Це білки м'язових тканин, шкірних рогових покривів, вовни й пір'я тощо.

Слайд #5
Усі без винятку хімічні реакції в організмі відбуваються у присутності спеціальних каталізаторів — ферментів, які являють собою білкові молекули. Вони прискорюють реакції в мільйони разів, причому кожну реакцію каталізує свій власний фермент.
Деякі білки виконують транспортні функції — переносять молекули або йони в місця синтезу або накопичення речовин. Наприклад, в крові міститься білок гемоглобін, що переносить кисень до тканин і вуглекислий газ від них, а білок міоглобін накопичує кисень у м'язах.
Деякі білки виконують транспортні функції — переносять молекули або йони в місця синтезу або накопичення речовин. Наприклад, в крові міститься білок гемоглобін, що переносить кисень до тканин і вуглекислий газ від них, а білок міоглобін накопичує кисень у м'язах.
Слайд #6
Білки — це будівельний матеріал клітин. З них побудовані опорні, м'язові, покривні тканини.
Білки-рецептори сприймають і передають сигнали, що надходять від сусідніх клітин або з навколишнього середовища. Наприклад, дія світла на сітківку ока сприймає білок родопсин.
Білки-рецептори сприймають і передають сигнали, що надходять від сусідніх клітин або з навколишнього середовища. Наприклад, дія світла на сітківку ока сприймає білок родопсин.
Слайд #7
Білки життєво необхідні будь-якому організму і тому є найважливішою складовою частиною продуктів харчування. У процесі травлення вони гідролізуються до амінокислот, які служать вихідною сировиною для синтезу інших білків, необхідних даному організму. Існують такі амінокислоти, які організм не в змозі синтезувати сам і одержує тільки з їжею,— їх називають незамінними.
Слайд #8
Харчова і біологічна цінність білків визначається збалансованістю амінокислот, що входять до їх складу. Різноманітне харчування-найправильніший шлях постачання організму повноцінними білками.
Найбільшу біологічну цінність мають білки тваринного походження. Фізіологічними нормами передбачається, що 55 % необхідних білків мають забезпечуватись за рахунок білків тваринного походження.
Найбільшу біологічну цінність мають білки тваринного походження. Фізіологічними нормами передбачається, що 55 % необхідних білків мають забезпечуватись за рахунок білків тваринного походження.

Слайд #9
Теплова обробка прискорює перетравлювання білків. Тривале розварювання, подрібнення, протирання продуктів поліпшує перетравлювання, і засвоювання білків, особливо рослинних. Проте надмірне нагрівання може негативно вплинути на амінокислоти, з яких складаються білки. Потреба в білках для дорослої людини становить у середньому 85- 90 г на день.
Слайд #10
Білок — важливий компонент їжі людини. Основні джерела харчового
білка: м'ясо, молоко, продукти переробки зерна, хліб, риба, овочі. Потре -ба в білку залежить від віку, статі, виду діяльності. В організмі здорової
людини повинен бути баланс між кількістю спожитих білків і продуктами
розпаду, що виділяються. Для оцінки білкового обміну уведене поняття біл-кового балансу.
білка: м'ясо, молоко, продукти переробки зерна, хліб, риба, овочі. Потре -ба в білку залежить від віку, статі, виду діяльності. В організмі здорової
людини повинен бути баланс між кількістю спожитих білків і продуктами
розпаду, що виділяються. Для оцінки білкового обміну уведене поняття біл-кового балансу.
