- Головна
- Готові шкільні презентації
- Презентація на тему «Білки. Будова та історія дослідження»
Презентація на тему «Білки. Будова та історія дослідження»
179
Слайд #1
Білки. Будова та історія дослідження.
Робота
учениці 10 класу
Домажирської ЗОШ
Гусак Христини
Робота
учениці 10 класу
Домажирської ЗОШ
Гусак Христини

Слайд #2
Білки
Білки́ — складні високомолекулярні природні органічні речовини, що складаються з амінокислот, сполучених пептидними зв'язками. В однині (білок) термін найчастіше використовують для посилання на білок як речовину, коли неважливий її конкретний склад, та на окремі молекули або типи білків, у множині (білки) — для посилання на певну кількість білків, коли точний склад важливий.
Зазвичай білки є лінійними полімерами — поліпептидами, хоча інколи мають складнішу структуру. Невеликі білкові молекули, тобто олігомери поліпептидів, називаються пептидами.
Білки́ — складні високомолекулярні природні органічні речовини, що складаються з амінокислот, сполучених пептидними зв'язками. В однині (білок) термін найчастіше використовують для посилання на білок як речовину, коли неважливий її конкретний склад, та на окремі молекули або типи білків, у множині (білки) — для посилання на певну кількість білків, коли точний склад важливий.
Зазвичай білки є лінійними полімерами — поліпептидами, хоча інколи мають складнішу структуру. Невеликі білкові молекули, тобто олігомери поліпептидів, називаються пептидами.

Слайд #3
Функції білків
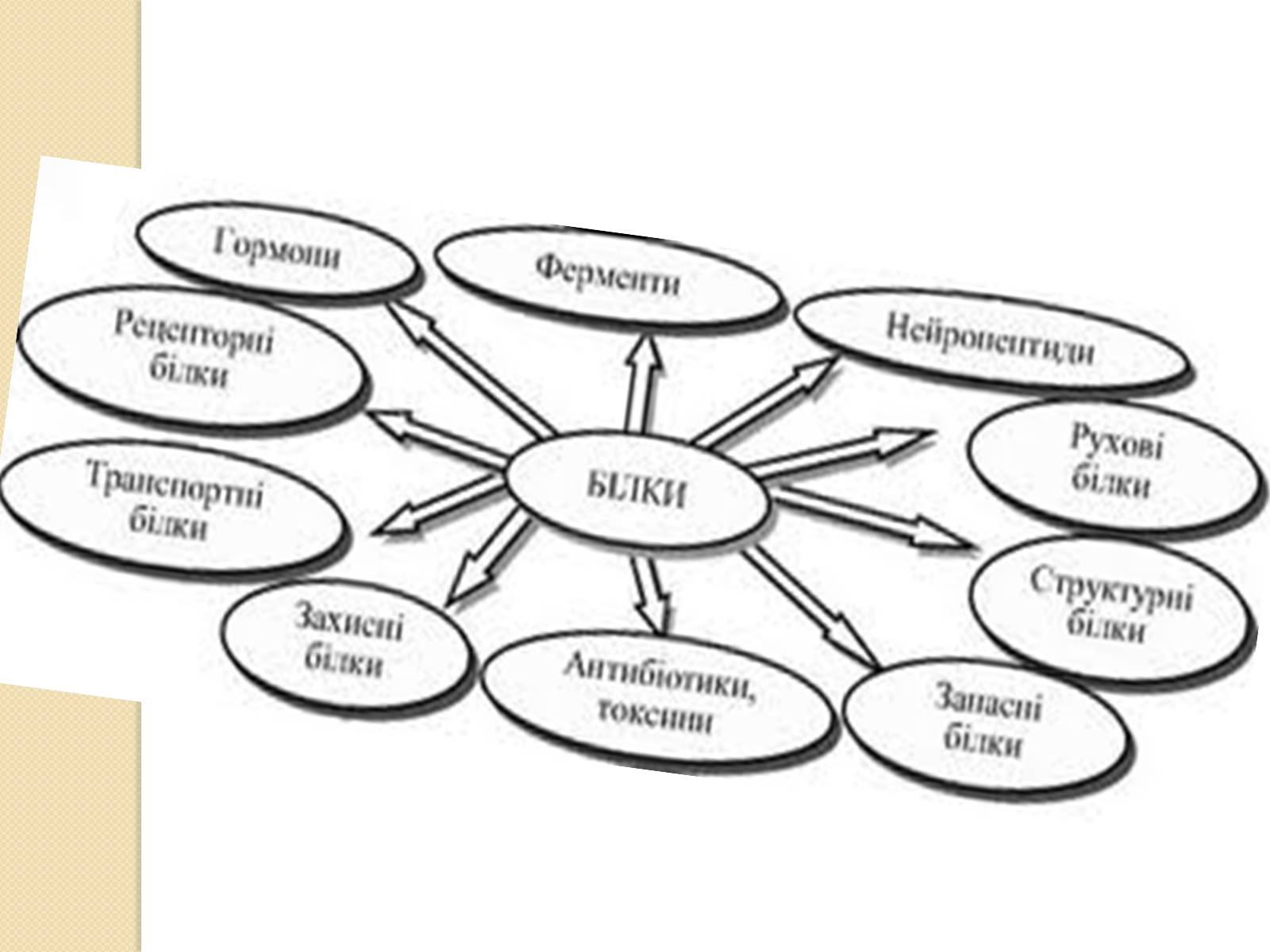
Функції білків в клітині різноманітніші, ніж функції інших біополімерів —полісахаридів і нуклеїнових кислот. Так, білки-ферменти каталізують протікання біохімічних реакцій і грають важливу роль в обміні речовин. Деякі білки виконують структурну або механічну функцію, утворюючи цитоскелет, що є важливим засобом підтримки форми клітин.
Функції білків в клітині різноманітніші, ніж функції інших біополімерів —полісахаридів і нуклеїнових кислот. Так, білки-ферменти каталізують протікання біохімічних реакцій і грають важливу роль в обміні речовин. Деякі білки виконують структурну або механічну функцію, утворюючи цитоскелет, що є важливим засобом підтримки форми клітин.

Слайд #4
Білки – важлива частина харчування.
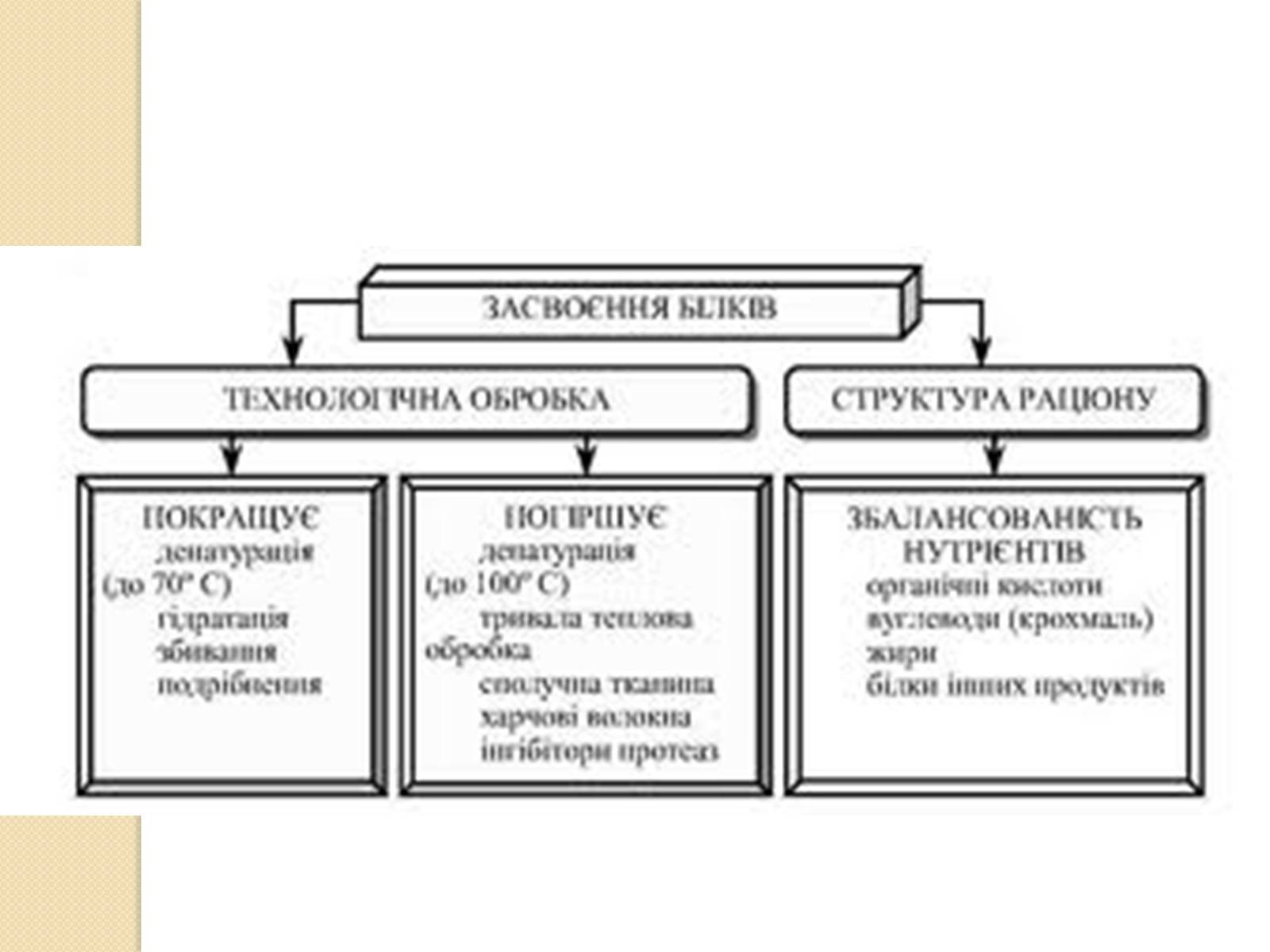
Білки — важлива частина харчування тварин і людини, оскільки ці організми не можуть синтезувати повний набір амінокислот і повинні отримувати частину з них із білковою їжею. У процесі травлення протелітичні ферменти руйнують спожиті білки, розкладаючи їх до рівня амінокислот, які використовуються при біосинтезі білків організму або піддаються подальшому розпаду для отримання енергії.
Білки — важлива частина харчування тварин і людини, оскільки ці організми не можуть синтезувати повний набір амінокислот і повинні отримувати частину з них із білковою їжею. У процесі травлення протелітичні ферменти руйнують спожиті білки, розкладаючи їх до рівня амінокислот, які використовуються при біосинтезі білків організму або піддаються подальшому розпаду для отримання енергії.

Слайд #5
Історія дослідження
Білки були виділені в окремий клас біологічних молекул у 18 столітті в результаті робіт французького хіміка Антуана де Фуркруа та інших учених, в яких було відмічено властивість білків коагулювати під час нагрівання або під дією кислот. У той час були досліджені такі білки, як альбумін з яєчних білків, фібрин з крові і глютен із зернапшениці. Голландський хімік Герріт Мульдер провів аналіз складу білків і виявив, що практично всі білки мають однакову емпіричну формулу. Мульдер також визначив продукти руйнування білків — амінокислоти — і для однієї з них (лейцину) майже точно визначив молекулярну масу — 131 дальтон.
Білки були виділені в окремий клас біологічних молекул у 18 столітті в результаті робіт французького хіміка Антуана де Фуркруа та інших учених, в яких було відмічено властивість білків коагулювати під час нагрівання або під дією кислот. У той час були досліджені такі білки, як альбумін з яєчних білків, фібрин з крові і глютен із зернапшениці. Голландський хімік Герріт Мульдер провів аналіз складу білків і виявив, що практично всі білки мають однакову емпіричну формулу. Мульдер також визначив продукти руйнування білків — амінокислоти — і для однієї з них (лейцину) майже точно визначив молекулярну масу — 131 дальтон.

Слайд #6
Будова
Молекули білків є лінійними полімерами, що складаються з α-L-амінокислот (які є мономерами цих полімерів) і, в деяких випадках, з модифікованих основних амінокислот (щоправда модифікації відбуваються вже після синтезу білків. При утворенні білка в результаті взаємодії α-аміногрупи (-NH2) однієї амінокислоти з α-карбоксильною групою (-СООН) іншої амінокислоти утворюються пептидні зв'язки. а на рибосомі).
При природному синтезі білка на рибосомі, нові амінокислоти приєднуються до C-кінця, тому назва пептиду або білка дається шляхом перерахування амінокислотних залишків починаючи з N-кінця.
Послідовність амінокислот у білку відповідає інформації, що міститься в гені даного білка. Ця інформація представлена у вигляді нуклеотидної послідовності, причому одній амінокислоті відповідає одна або декілька послідовностей з трьохнуклеотидів — так званих кодонів.
Молекули білків є лінійними полімерами, що складаються з α-L-амінокислот (які є мономерами цих полімерів) і, в деяких випадках, з модифікованих основних амінокислот (щоправда модифікації відбуваються вже після синтезу білків. При утворенні білка в результаті взаємодії α-аміногрупи (-NH2) однієї амінокислоти з α-карбоксильною групою (-СООН) іншої амінокислоти утворюються пептидні зв'язки. а на рибосомі).
При природному синтезі білка на рибосомі, нові амінокислоти приєднуються до C-кінця, тому назва пептиду або білка дається шляхом перерахування амінокислотних залишків починаючи з N-кінця.
Послідовність амінокислот у білку відповідає інформації, що міститься в гені даного білка. Ця інформація представлена у вигляді нуклеотидної послідовності, причому одній амінокислоті відповідає одна або декілька послідовностей з трьохнуклеотидів — так званих кодонів.

Слайд #7
Прості і складні білки
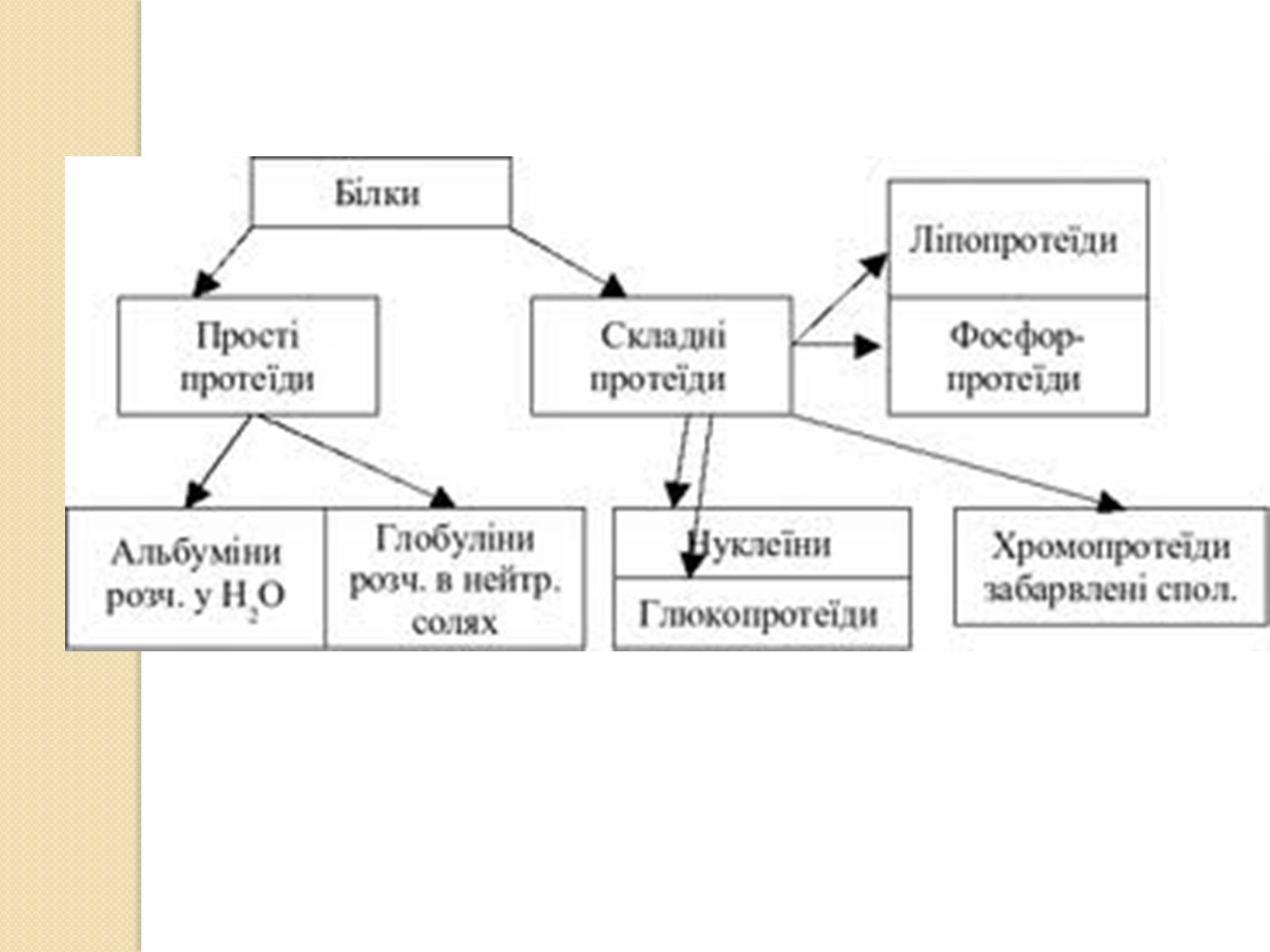
За складом виділяють прості і складні білки. Прості білки містять тільки амінокислоти, зв'язані в ланцюжки. На відміну від них складні білки мають також неамінокислотні групи. Ці додаткові групи у складі складних білків називаються простетичними групами. Деякі простетичні групи служать кофакторами, необхідними для роботи ферментів. Інші, такі як полісахаридніланцюжки, допомагають білку приймати потрібну конформацію і додають додаткову стабільність. Неорганічні простетичні групи найчастіше складаються з іонів металів, найпоширенішими з яких є цинк, магній і молібден[14]. За типом простетичної групи складні білки поділяють на глікопротеїни, ліпопротеїни, хромопротеїни, нуклеопротеїни, фосфопротеїни, металопротеїни та деякі інші.
За складом виділяють прості і складні білки. Прості білки містять тільки амінокислоти, зв'язані в ланцюжки. На відміну від них складні білки мають також неамінокислотні групи. Ці додаткові групи у складі складних білків називаються простетичними групами. Деякі простетичні групи служать кофакторами, необхідними для роботи ферментів. Інші, такі як полісахаридніланцюжки, допомагають білку приймати потрібну конформацію і додають додаткову стабільність. Неорганічні простетичні групи найчастіше складаються з іонів металів, найпоширенішими з яких є цинк, магній і молібден[14]. За типом простетичної групи складні білки поділяють на глікопротеїни, ліпопротеїни, хромопротеїни, нуклеопротеїни, фосфопротеїни, металопротеїни та деякі інші.

Слайд #8
Денатурація білка
Як правило, білки протягом досить довгого часу зберігають структуру і, отже, фізико-хімічні властивості, наприклад, розчинність, в умовах (таких як pH, температура), до яких пристосований даний організм або які підтримуються в його межах в результаті збереження гомеостазу[7]. Різка зміна цих умов, наприклад, внаслідок нагрівання або обробки білка кислотою чи лугом, приводить до втрати четвертинної, третинної і вторинної структур білка, цей процес називається денатурацією. Відомий випадок денатурації білка в побуті — приготування курячого яйця, коли під впливом високої температури розчинний у воді прозорий білок овальбумін стає щільним, нерозчинним і непрозорим.
Як правило, білки протягом досить довгого часу зберігають структуру і, отже, фізико-хімічні властивості, наприклад, розчинність, в умовах (таких як pH, температура), до яких пристосований даний організм або які підтримуються в його межах в результаті збереження гомеостазу[7]. Різка зміна цих умов, наприклад, внаслідок нагрівання або обробки білка кислотою чи лугом, приводить до втрати четвертинної, третинної і вторинної структур білка, цей процес називається денатурацією. Відомий випадок денатурації білка в побуті — приготування курячого яйця, коли під впливом високої температури розчинний у воді прозорий білок овальбумін стає щільним, нерозчинним і непрозорим.

Слайд #9
Використання в промисловості
. Серед всіх білків в харчовій промисловості активно використовуються численні ферменти. Так, у пекарській промисловостівикористовуються альфа-амілаза і протеази; у пивоварінні використовуються численні ферменти ячменю (амілаза, глюканази, протеази); целюлази і пектинази використовуються для освітлення соків.
хімозин, ліпаза і лактаза використовуються для виготовлення кисломолочних продуктів; а папаїн застосовується для пом'якшення м'ясних продуктів. Для виготовленнякрохмалю використовують амілазу і глюкоамілазу, а для виготовлення папіру — целюлази і ксиланазу. Також протео- і ліполітичні ферменти часто додаються до миючих засобів.
Іншим використанням білків є використання фібрилярних білків для виготовлення волокон, що використовуються, зокрема, втекстильній промисловисті
. Серед всіх білків в харчовій промисловості активно використовуються численні ферменти. Так, у пекарській промисловостівикористовуються альфа-амілаза і протеази; у пивоварінні використовуються численні ферменти ячменю (амілаза, глюканази, протеази); целюлази і пектинази використовуються для освітлення соків.
хімозин, ліпаза і лактаза використовуються для виготовлення кисломолочних продуктів; а папаїн застосовується для пом'якшення м'ясних продуктів. Для виготовленнякрохмалю використовують амілазу і глюкоамілазу, а для виготовлення папіру — целюлази і ксиланазу. Також протео- і ліполітичні ферменти часто додаються до миючих засобів.
Іншим використанням білків є використання фібрилярних білків для виготовлення волокон, що використовуються, зокрема, втекстильній промисловисті

Слайд #10
Використання в промисловості
. Серед всіх білків в харчовій промисловості активно використовуються численні ферменти. Так, у пекарській промисловостівикористовуються альфа-амілаза і протеази; у пивоварінні використовуються численні ферменти ячменю (амілаза, глюканази, протеази); целюлази і пектинази використовуються для освітлення соків.
хімозин, ліпаза і лактаза використовуються для виготовлення кисломолочних продуктів; а папаїн застосовується для пом'якшення м'ясних продуктів. Для виготовленнякрохмалю використовують амілазу і глюкоамілазу, а для виготовлення папіру — целюлази і ксиланазу. Також протео- і ліполітичні ферменти часто додаються до миючих засобів.
Іншим використанням білків є використання фібрилярних білків для виготовлення волокон, що використовуються, зокрема, втекстильній промисловисті
. Серед всіх білків в харчовій промисловості активно використовуються численні ферменти. Так, у пекарській промисловостівикористовуються альфа-амілаза і протеази; у пивоварінні використовуються численні ферменти ячменю (амілаза, глюканази, протеази); целюлази і пектинази використовуються для освітлення соків.
хімозин, ліпаза і лактаза використовуються для виготовлення кисломолочних продуктів; а папаїн застосовується для пом'якшення м'ясних продуктів. Для виготовленнякрохмалю використовують амілазу і глюкоамілазу, а для виготовлення папіру — целюлази і ксиланазу. Також протео- і ліполітичні ферменти часто додаються до миючих засобів.
Іншим використанням білків є використання фібрилярних білків для виготовлення волокон, що використовуються, зокрема, втекстильній промисловисті
Слайд #11
Використання в промисловості
. Серед всіх білків в харчовій промисловості активно використовуються численні ферменти. Так, у пекарській промисловостівикористовуються альфа-амілаза і протеази; у пивоварінні використовуються численні ферменти ячменю (амілаза, глюканази, протеази); целюлази і пектинази використовуються для освітлення соків.
хімозин, ліпаза і лактаза використовуються для виготовлення кисломолочних продуктів; а папаїн застосовується для пом'якшення м'ясних продуктів. Для виготовленнякрохмалю використовують амілазу і глюкоамілазу, а для виготовлення папіру — целюлази і ксиланазу. Також протео- і ліполітичні ферменти часто додаються до миючих засобів.
Іншим використанням білків є використання фібрилярних білків для виготовлення волокон, що використовуються, зокрема, втекстильній промисловисті
. Серед всіх білків в харчовій промисловості активно використовуються численні ферменти. Так, у пекарській промисловостівикористовуються альфа-амілаза і протеази; у пивоварінні використовуються численні ферменти ячменю (амілаза, глюканази, протеази); целюлази і пектинази використовуються для освітлення соків.
хімозин, ліпаза і лактаза використовуються для виготовлення кисломолочних продуктів; а папаїн застосовується для пом'якшення м'ясних продуктів. Для виготовленнякрохмалю використовують амілазу і глюкоамілазу, а для виготовлення папіру — целюлази і ксиланазу. Також протео- і ліполітичні ферменти часто додаються до миючих засобів.
Іншим використанням білків є використання фібрилярних білків для виготовлення волокон, що використовуються, зокрема, втекстильній промисловисті
Слайд #12
Використання в промисловості
. Серед всіх білків в харчовій промисловості активно використовуються численні ферменти. Так, у пекарській промисловостівикористовуються альфа-амілаза і протеази; у пивоварінні використовуються численні ферменти ячменю (амілаза, глюканази, протеази); целюлази і пектинази використовуються для освітлення соків.
хімозин, ліпаза і лактаза використовуються для виготовлення кисломолочних продуктів; а папаїн застосовується для пом'якшення м'ясних продуктів. Для виготовленнякрохмалю використовують амілазу і глюкоамілазу, а для виготовлення папіру — целюлази і ксиланазу. Також протео- і ліполітичні ферменти часто додаються до миючих засобів.
Іншим використанням білків є використання фібрилярних білків для виготовлення волокон, що використовуються, зокрема, втекстильній промисловисті
. Серед всіх білків в харчовій промисловості активно використовуються численні ферменти. Так, у пекарській промисловостівикористовуються альфа-амілаза і протеази; у пивоварінні використовуються численні ферменти ячменю (амілаза, глюканази, протеази); целюлази і пектинази використовуються для освітлення соків.
хімозин, ліпаза і лактаза використовуються для виготовлення кисломолочних продуктів; а папаїн застосовується для пом'якшення м'ясних продуктів. Для виготовленнякрохмалю використовують амілазу і глюкоамілазу, а для виготовлення папіру — целюлази і ксиланазу. Також протео- і ліполітичні ферменти часто додаються до миючих засобів.
Іншим використанням білків є використання фібрилярних білків для виготовлення волокон, що використовуються, зокрема, втекстильній промисловисті
Слайд #13
Використання в промисловості
. Серед всіх білків в харчовій промисловості активно використовуються численні ферменти. Так, у пекарській промисловостівикористовуються альфа-амілаза і протеази; у пивоварінні використовуються численні ферменти ячменю (амілаза, глюканази, протеази); целюлази і пектинази використовуються для освітлення соків.
хімозин, ліпаза і лактаза використовуються для виготовлення кисломолочних продуктів; а папаїн застосовується для пом'якшення м'ясних продуктів. Для виготовленнякрохмалю використовують амілазу і глюкоамілазу, а для виготовлення папіру — целюлази і ксиланазу. Також протео- і ліполітичні ферменти часто додаються до миючих засобів.
Іншим використанням білків є використання фібрилярних білків для виготовлення волокон, що використовуються, зокрема, втекстильній промисловисті
. Серед всіх білків в харчовій промисловості активно використовуються численні ферменти. Так, у пекарській промисловостівикористовуються альфа-амілаза і протеази; у пивоварінні використовуються численні ферменти ячменю (амілаза, глюканази, протеази); целюлази і пектинази використовуються для освітлення соків.
хімозин, ліпаза і лактаза використовуються для виготовлення кисломолочних продуктів; а папаїн застосовується для пом'якшення м'ясних продуктів. Для виготовленнякрохмалю використовують амілазу і глюкоамілазу, а для виготовлення папіру — целюлази і ксиланазу. Також протео- і ліполітичні ферменти часто додаються до миючих засобів.
Іншим використанням білків є використання фібрилярних білків для виготовлення волокон, що використовуються, зокрема, втекстильній промисловисті

Слайд #14
Дякую за увагу!!!!*)
