- Головна
- Готові шкільні презентації
- Презентація на тему «Белки: состав и строение»
Презентація на тему «Белки: состав и строение»
202
Слайд #1
Белки: состав и строение.
Автор:
учитель биологии
МОУ «Лицей №37»
г. Саратова Киселева О.Н.
Автор:
учитель биологии
МОУ «Лицей №37»
г. Саратова Киселева О.Н.

Слайд #2
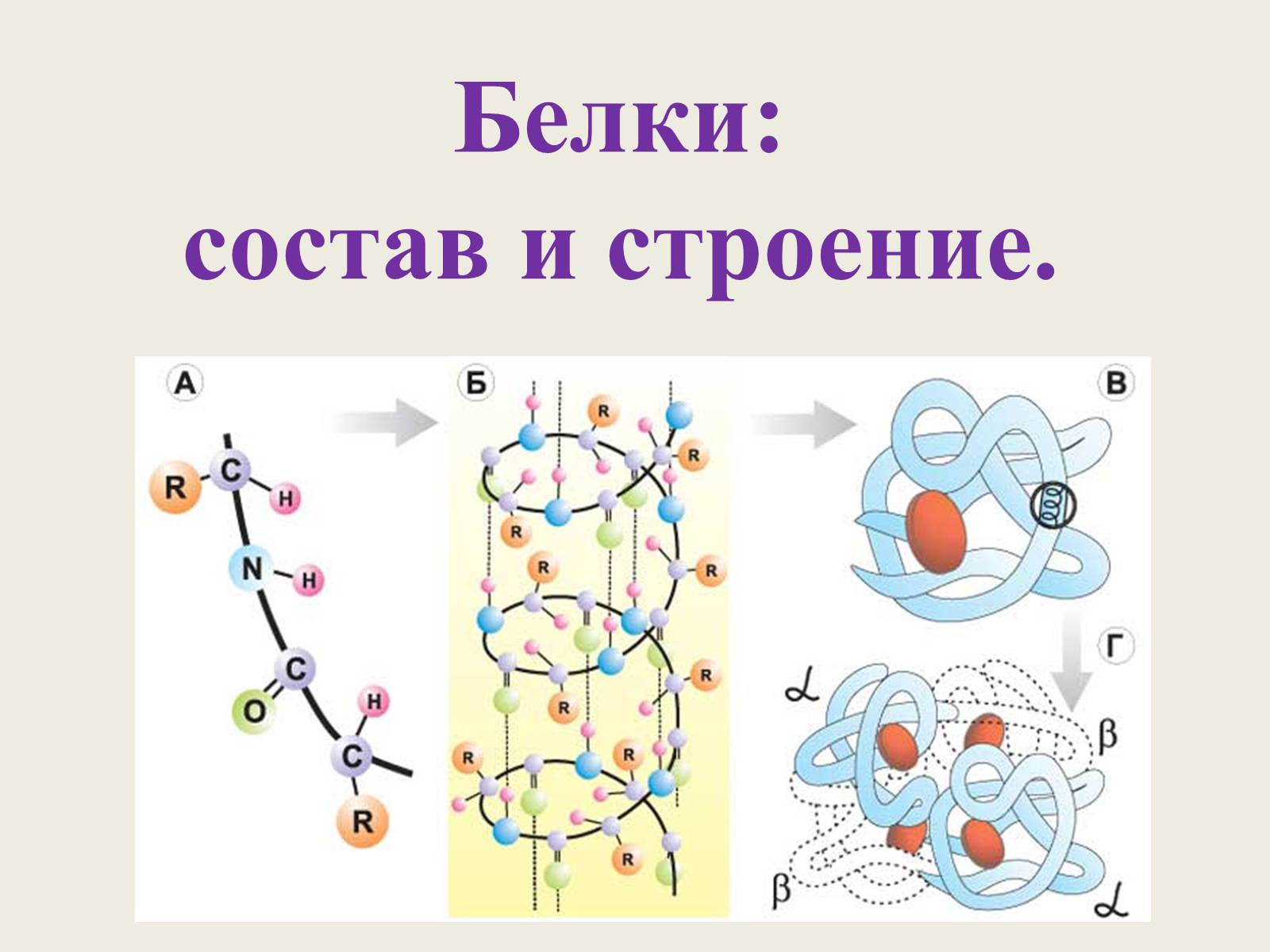
Белки: состав и строение.
Слайд #3
Белки
Белки обладают огромной молекулярной массой: молекулярная масса альбумина (одного из белков яйца) — 36000, гемоглобина — 152000, миозина (одного из белков мышц) — 500000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Белки обладают огромной молекулярной массой: молекулярная масса альбумина (одного из белков яйца) — 36000, гемоглобина — 152000, миозина (одного из белков мышц) — 500000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.

Слайд #4
Белки
Белки - (протеины, полипептиды) - высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в цепочку пептидной связью.
Белки –гетерополимеры, мономерами котрых являются α-аминокислоты.
В состав белков входят: С, Н, О, N, S. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки - (протеины, полипептиды) - высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в цепочку пептидной связью.
Белки –гетерополимеры, мономерами котрых являются α-аминокислоты.
В состав белков входят: С, Н, О, N, S. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.

Слайд #5
Классификация белков
белки
простые
сложные
состоят из остатков аминокислот
кроме аминокислот содержат небелковую - простетическую группу:
атомы металла – металлопротеины
молекулу липида – липопротеины
молекулу углевода – гликопротеины
остаток фосфорной кислоты – фосфопротеины
молекулу нуклеиновой кислоты – нуклеопротеины
белки
простые
сложные
состоят из остатков аминокислот
кроме аминокислот содержат небелковую - простетическую группу:
атомы металла – металлопротеины
молекулу липида – липопротеины
молекулу углевода – гликопротеины
остаток фосфорной кислоты – фосфопротеины
молекулу нуклеиновой кислоты – нуклеопротеины

Слайд #6
Состав белков
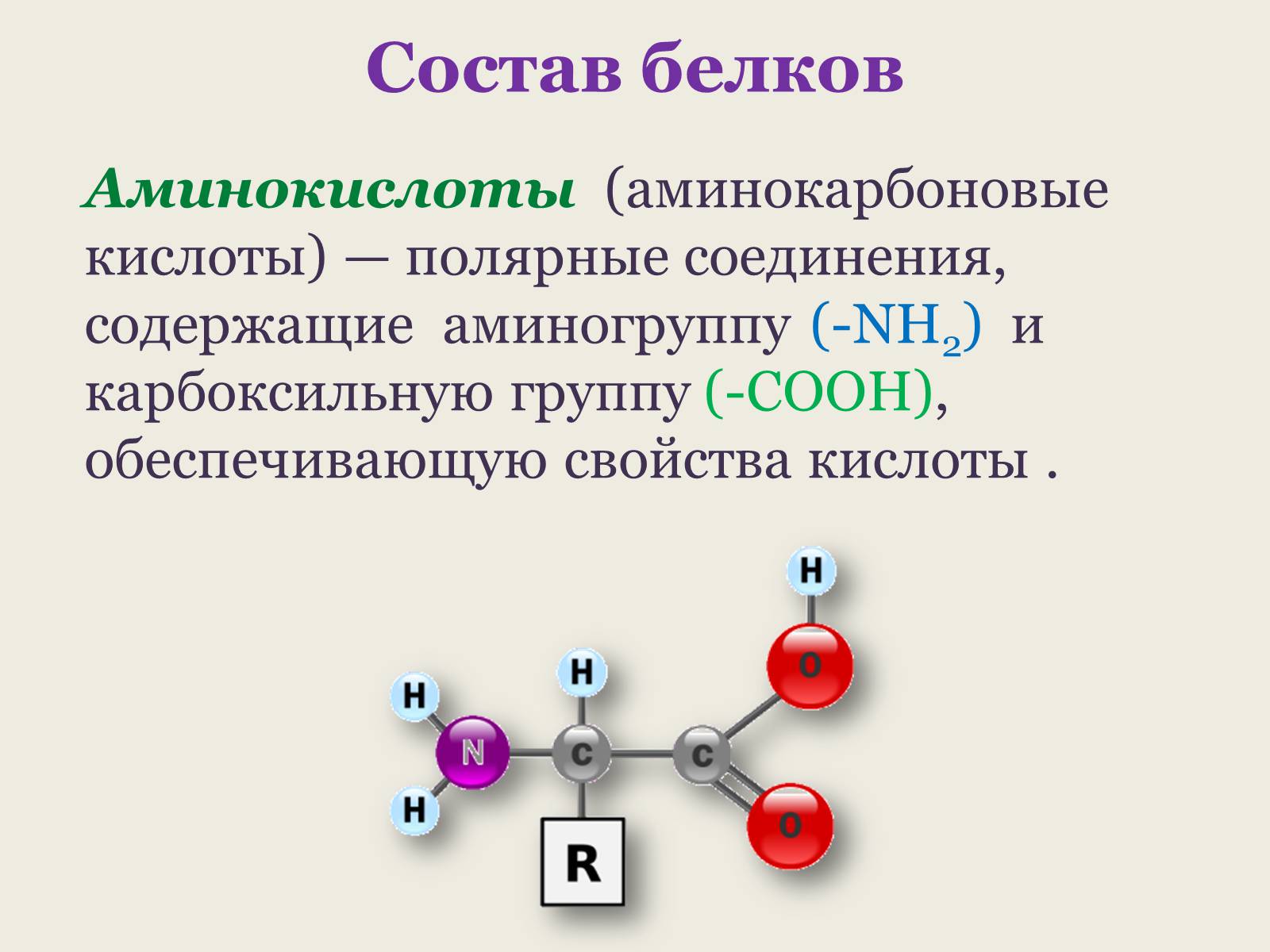
Аминокислоты (аминокарбоновые кислоты) — полярные соединения, содержащие аминогруппу t(-NH2) и карбоксильную группу (-COOH), обеспечивающую свойства кислоты .
Аминокислоты (аминокарбоновые кислоты) — полярные соединения, содержащие аминогруппу t(-NH2) и карбоксильную группу (-COOH), обеспечивающую свойства кислоты .
Слайд #7
Состав белков
В клетках и тканях обнаружено свыше 170 различных аминокислот, но в состав белков входит лишь 26.
Причем 6 из 26 аминокислот являются нестандартными. Они образуются в результате модификации стандартных аминокислот уже после их включения в полипептидную цепь. Поэтому обычными компонентами белков считают лишь 20 аминокислот.
Аминокислоты
Заменимые
синтезируются в организме (10)
Незаменимые
в организме не синтезируются (10)
В клетках и тканях обнаружено свыше 170 различных аминокислот, но в состав белков входит лишь 26.
Причем 6 из 26 аминокислот являются нестандартными. Они образуются в результате модификации стандартных аминокислот уже после их включения в полипептидную цепь. Поэтому обычными компонентами белков считают лишь 20 аминокислот.
Аминокислоты
Заменимые
синтезируются в организме (10)
Незаменимые
в организме не синтезируются (10)

Слайд #8
Состав белков
В зависимости от аминокислотного состава, белки бывают:
полноценными – белки, содержащие весь набор аминокислот (20 разных аминокислот);
неполноценными – белки, в составе которых какие-то аминокислоты отсутствуют.
Аминокислоты
Заменимые
синтезируются в организме
Незаменимые
в организме не синтезируются
В зависимости от аминокислотного состава, белки бывают:
полноценными – белки, содержащие весь набор аминокислот (20 разных аминокислот);
неполноценными – белки, в составе которых какие-то аминокислоты отсутствуют.
Аминокислоты
Заменимые
синтезируются в организме
Незаменимые
в организме не синтезируются
Слайд #9
Состав белков
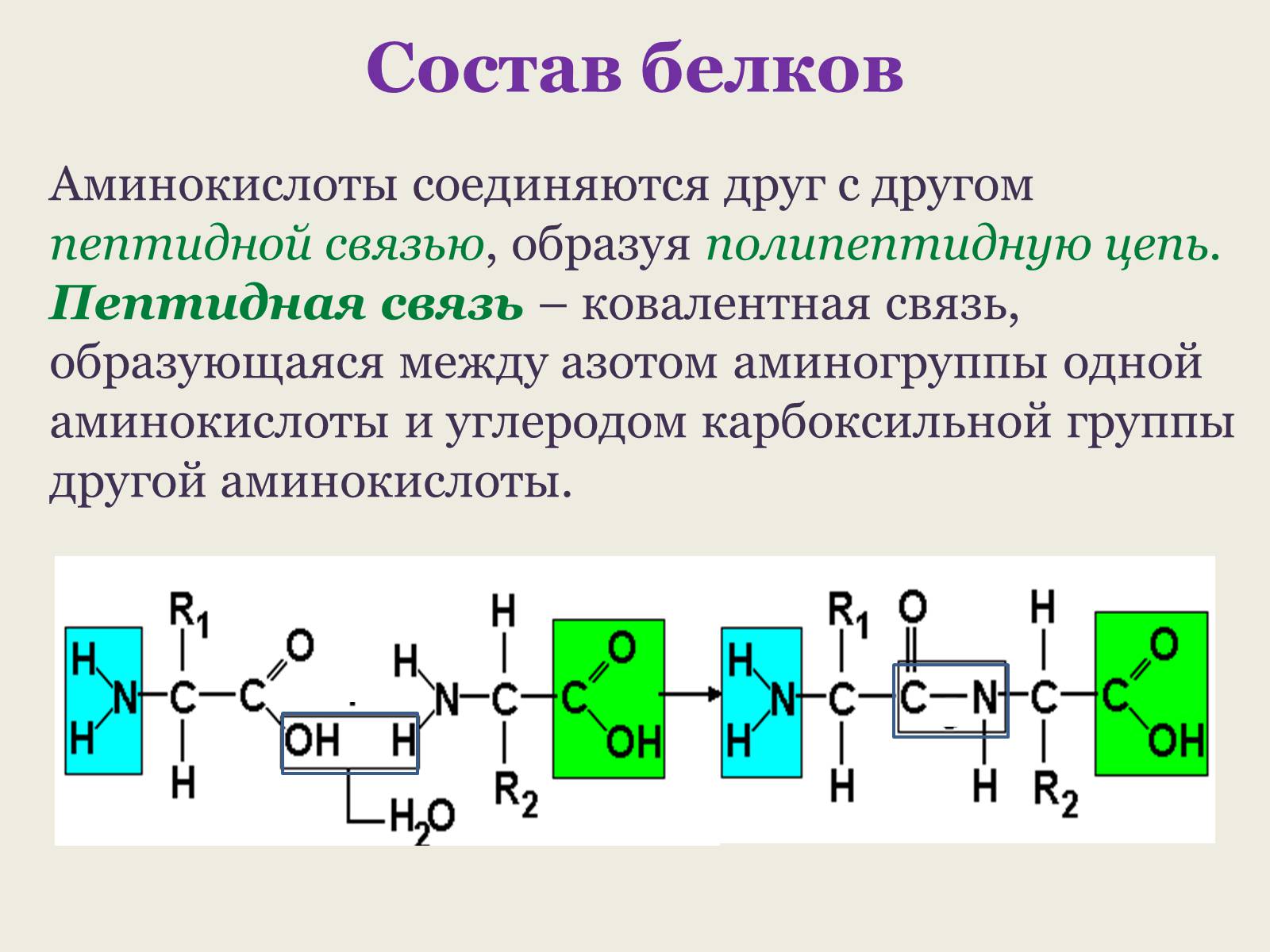
Аминокислоты соединяются друг с другом пептидной связью, образуя полипептидную цепь. Пептидная связь – ковалентная связь, образующаяся между азотом аминогруппы одной аминокислоты и углеродом карбоксильной группы другой аминокислоты.
Аминокислоты соединяются друг с другом пептидной связью, образуя полипептидную цепь. Пептидная связь – ковалентная связь, образующаяся между азотом аминогруппы одной аминокислоты и углеродом карбоксильной группы другой аминокислоты.
Слайд #10
Структура молекулы белка
Первичная структура – последовательность расположения аминокислотных остатков в полипептидной цепи.
Выделяют 4 уровня пространственной организации белков.
Первичная структура – последовательность расположения аминокислотных остатков в полипептидной цепи.
Выделяют 4 уровня пространственной организации белков.

Слайд #11
Структура молекулы белка
В организме человека обнаружено порядка 10 тыс. различных белков. Имея всего лишь 20 аминокислот, можно составить из них огромное количество самых разнообразных комбинаций.
Так, если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Белки же, выделенные из живых организмов, образованы сотнями, а иногда и тысячами аминокислот.
В организме человека обнаружено порядка 10 тыс. различных белков. Имея всего лишь 20 аминокислот, можно составить из них огромное количество самых разнообразных комбинаций.
Так, если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Белки же, выделенные из живых организмов, образованы сотнями, а иногда и тысячами аминокислот.

Слайд #12
Структура молекулы белка
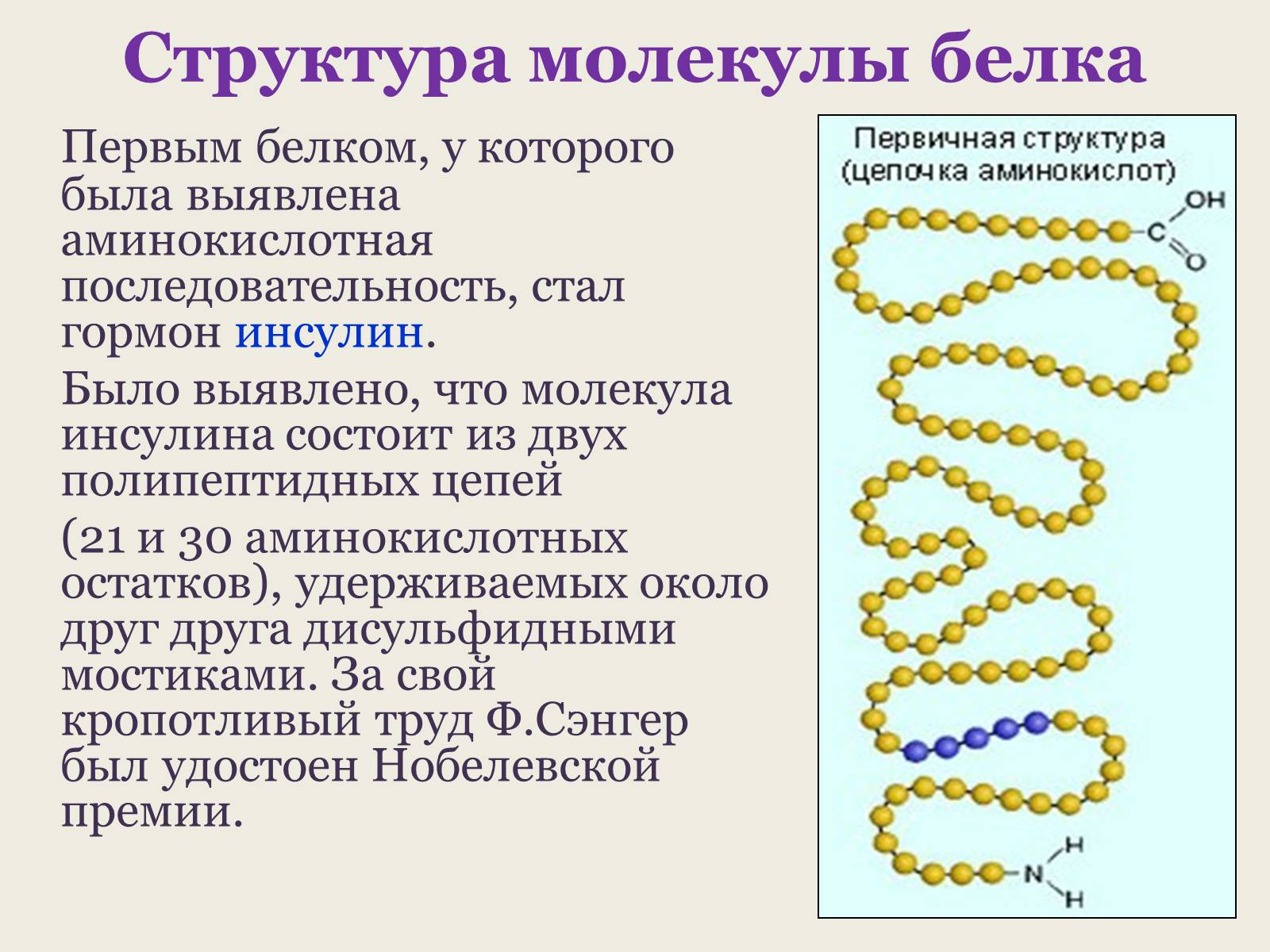
Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин.
Было выявлено, что молекула инсулина состоит из двух полипептидных цепей
(21 и 30 аминокислотных остатков), удерживаемых около друг друга дисульфидными мостиками. За свой кропотливый труд Ф.Сэнгер был удостоен Нобелевской премии.
Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин.
Было выявлено, что молекула инсулина состоит из двух полипептидных цепей
(21 и 30 аминокислотных остатков), удерживаемых около друг друга дисульфидными мостиками. За свой кропотливый труд Ф.Сэнгер был удостоен Нобелевской премии.
Слайд #13
Структура молекулы белка
Первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке может привести к изменению свойств и функций белка.
Лишь незначительное количество белков имеет строго линейную структуру. Основная масса белков подвергается дальнейшей укладке, что приводит к образованию вторичной структуры белковой молекулы.
Первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке может привести к изменению свойств и функций белка.
Лишь незначительное количество белков имеет строго линейную структуру. Основная масса белков подвергается дальнейшей укладке, что приводит к образованию вторичной структуры белковой молекулы.

Слайд #14
Структура молекулы белка
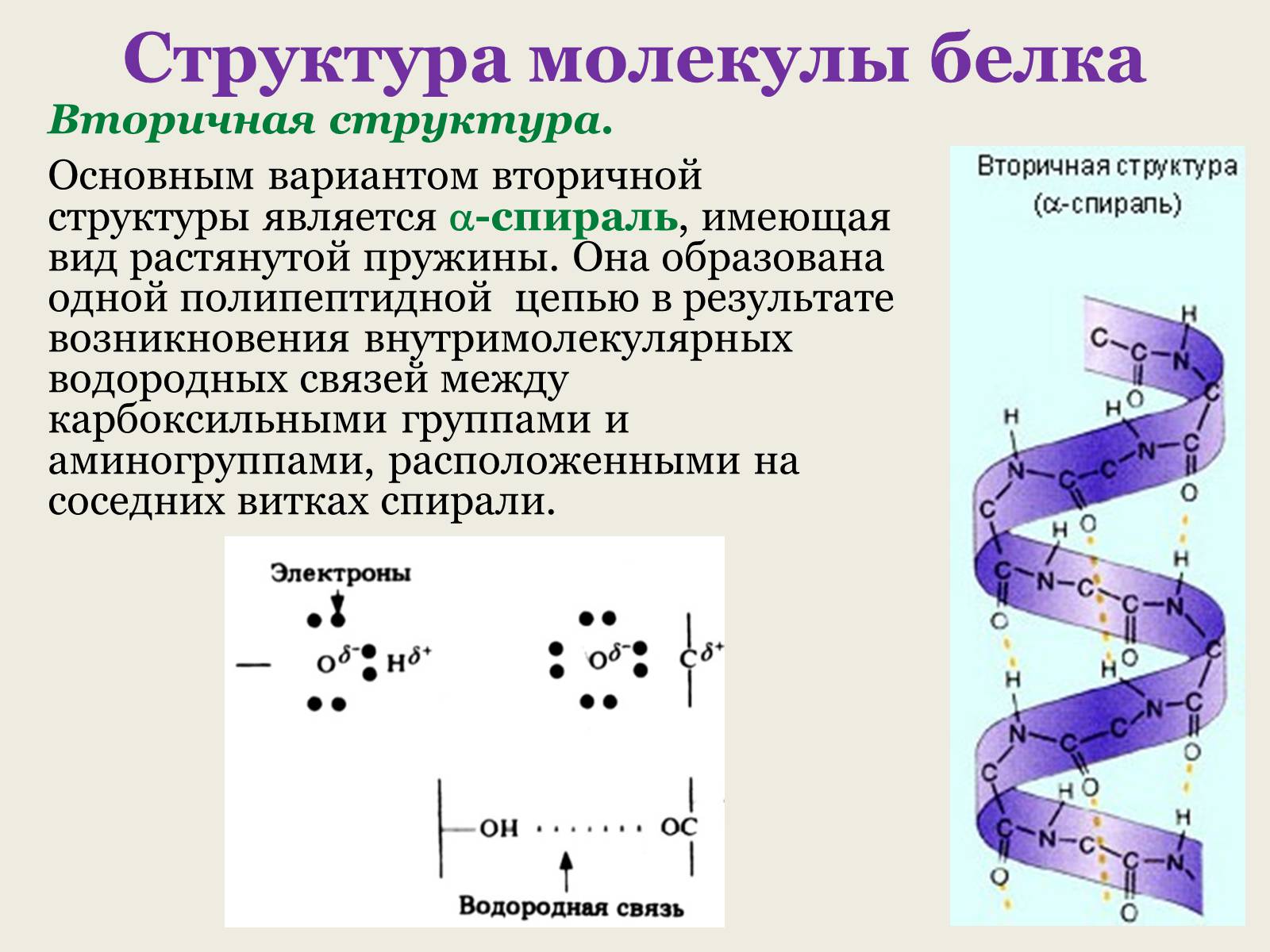
Вторичная структура.
Основным вариантом вторичной структуры является -спираль, имеющая вид растянутой пружины. Она образована одной полипептидной цепью в результате возникновения внутримолекулярных водородных связей между карбоксильными группами и аминогруппами, расположенными на соседних витках спирали.
Вторичная структура.
Основным вариантом вторичной структуры является -спираль, имеющая вид растянутой пружины. Она образована одной полипептидной цепью в результате возникновения внутримолекулярных водородных связей между карбоксильными группами и аминогруппами, расположенными на соседних витках спирали.
Слайд #15
Структура молекулы белка
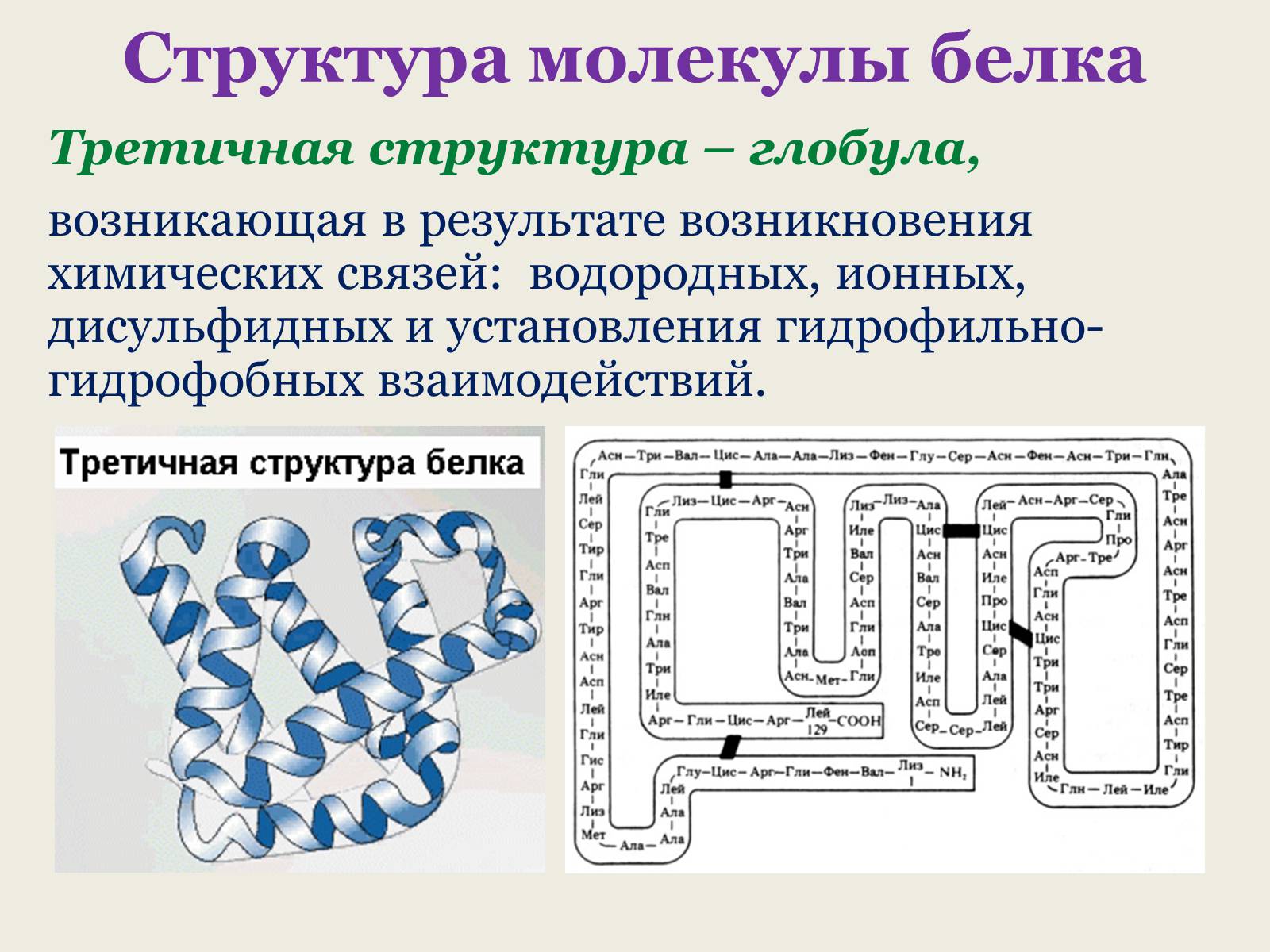
Третичная структура – глобула,
возникающая в результате возникновения химических связей: водородных, ионных, дисульфидных и установления гидрофильно-гидрофобных взаимодействий.
Третичная структура – глобула,
возникающая в результате возникновения химических связей: водородных, ионных, дисульфидных и установления гидрофильно-гидрофобных взаимодействий.
Слайд #16
Структура белковой молекулы
Четвертичная структура.
Характерна для сложных белков, молекулы которых образованы двумя и более глобулами.
Глобулы удерживаются вместе благодаря ионным, гидрофильно-гидрофобным и электростатическим взаимодействиям.
Четвертичная структура.
Характерна для сложных белков, молекулы которых образованы двумя и более глобулами.
Глобулы удерживаются вместе благодаря ионным, гидрофильно-гидрофобным и электростатическим взаимодействиям.

Слайд #17
Структура белковой молекулы
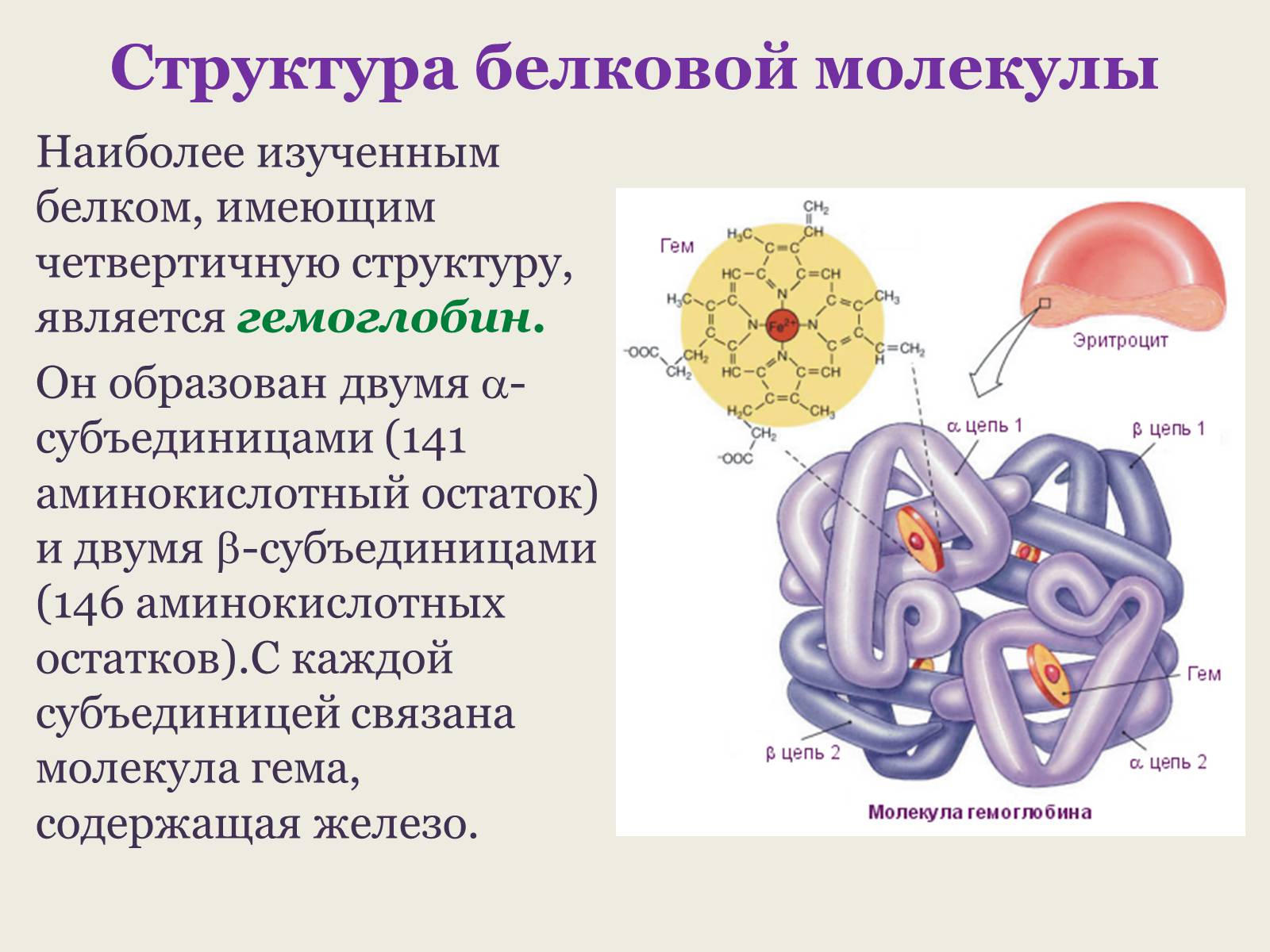
Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин.
Он образован двумя -субъединицами (141 аминокислотный остаток) и двумя -субъединицами (146 аминокислотных остатков).С каждой субъединицей связана молекула гема, содержащая железо.
Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин.
Он образован двумя -субъединицами (141 аминокислотный остаток) и двумя -субъединицами (146 аминокислотных остатков).С каждой субъединицей связана молекула гема, содержащая железо.