- Головна
- Готові шкільні презентації
- Презентація на тему «Сульфатна кислота і сульфати» (варіант 2)
Презентація на тему «Сульфатна кислота і сульфати» (варіант 2)
352
Слайд #1
«Навряд чи знайдеться інша речовина, що добувається людиною, яка настільки часто використовується в техніці, як сірчана кислота»
Д.І.Менделєєв
Д.І.Менделєєв

Слайд #2
Сульфатна кислота і сульфати.

Слайд #3
Сульфур (VI) оксид (сірчаний ангідрид, триоксид сірки)
SO3 — вищий оксид сірки.
У звичайних умовах легколетка безбарвна рідина із задушливим запахом. При температурах нижче 16,9 °C застигає з утворенням суміші різних кристалічних модифікацій твердого SO3.
Сірчаний ангідрид отримують, окиснюючи оксид сірки(IV) киснем повітря при нагріванні, у присутності каталізатора.
Сульфур (VI) оксид можна отримати термічним розкладом сульфатів:
Fe2(SO4) 3 → Fe2O3 + 3SO3
SO3 — вищий оксид сірки.
У звичайних умовах легколетка безбарвна рідина із задушливим запахом. При температурах нижче 16,9 °C застигає з утворенням суміші різних кристалічних модифікацій твердого SO3.
Сірчаний ангідрид отримують, окиснюючи оксид сірки(IV) киснем повітря при нагріванні, у присутності каталізатора.
Сульфур (VI) оксид можна отримати термічним розкладом сульфатів:
Fe2(SO4) 3 → Fe2O3 + 3SO3

Слайд #4
При взаємодії з водою утворює сульфатну кислоту:
SO3 + H2O → H2SO4.
Взаємодіє з розчинними основами, утворюючи середні та кислі солі:
2KOH + SO3 → K2SO4 + H2O
KOH + SO3 → KНSO4
SO3 розчиняється в 100%-й сірчаній кислоті, утворюючи олеум:
H2SO4 (100 %) + SO3 > H2S2O7.
SO3 + H2O → H2SO4.
Взаємодіє з розчинними основами, утворюючи середні та кислі солі:
2KOH + SO3 → K2SO4 + H2O
KOH + SO3 → KНSO4
SO3 розчиняється в 100%-й сірчаній кислоті, утворюючи олеум:
H2SO4 (100 %) + SO3 > H2S2O7.

Слайд #5
Історична довідка
Сірчану кислоту отримують вже більше 1000 років.
Спочатку її отримували алхіміки з «зеленого каменю» (залізний купорос) або квасців шляхом сильного нагрівання (прожарювання).
Так, наприклад, із залізного купоросу отримували важку маслянисту рідину - купоросне масло:2 [FeSO4 • 7Н2O] = Fe2O3 + Н2SO4 + SO2 + 13Н2O.
Сірчану кислоту отримують вже більше 1000 років.
Спочатку її отримували алхіміки з «зеленого каменю» (залізний купорос) або квасців шляхом сильного нагрівання (прожарювання).
Так, наприклад, із залізного купоросу отримували важку маслянисту рідину - купоросне масло:2 [FeSO4 • 7Н2O] = Fe2O3 + Н2SO4 + SO2 + 13Н2O.

Слайд #6
Перша згадка про кислі гази, що отримуються при прожарюванні квасців або залізного купоросу «зеленого каменя», зустрічається у записах арабського алхіміка Джабір ібн Хайяна.
Пізніше, в IX столітті персидський алхімік Аль-Разі, прожарюючи суміш залізного і мідного купоросу (FeSO4•7H2O і CuSO4•5H2O), також отримав розчин сірчаної кислоти.
Пізніше, в IX столітті персидський алхімік Аль-Разі, прожарюючи суміш залізного і мідного купоросу (FeSO4•7H2O і CuSO4•5H2O), також отримав розчин сірчаної кислоти.

Слайд #7
Але перші детальні описи добування сірчаної кислоти («Купорового масла») дали італійський вчений В.Берінгучо та німецький алхімік , чиї праці були опубліковані під іменем Василя Валентина в кінці ХVІ століття.

Слайд #8
Сульфатна кислота являє собою безбарвну маслянисту рідину, що перетворюється при 10, 4 ° С в тверду кристалічну масу.
За звичайних умов концентрована сірчана кислота — важка масляниста рідина без кольору і запаху.
За звичайних умов концентрована сірчана кислота — важка масляниста рідина без кольору і запаху.

Слайд #9
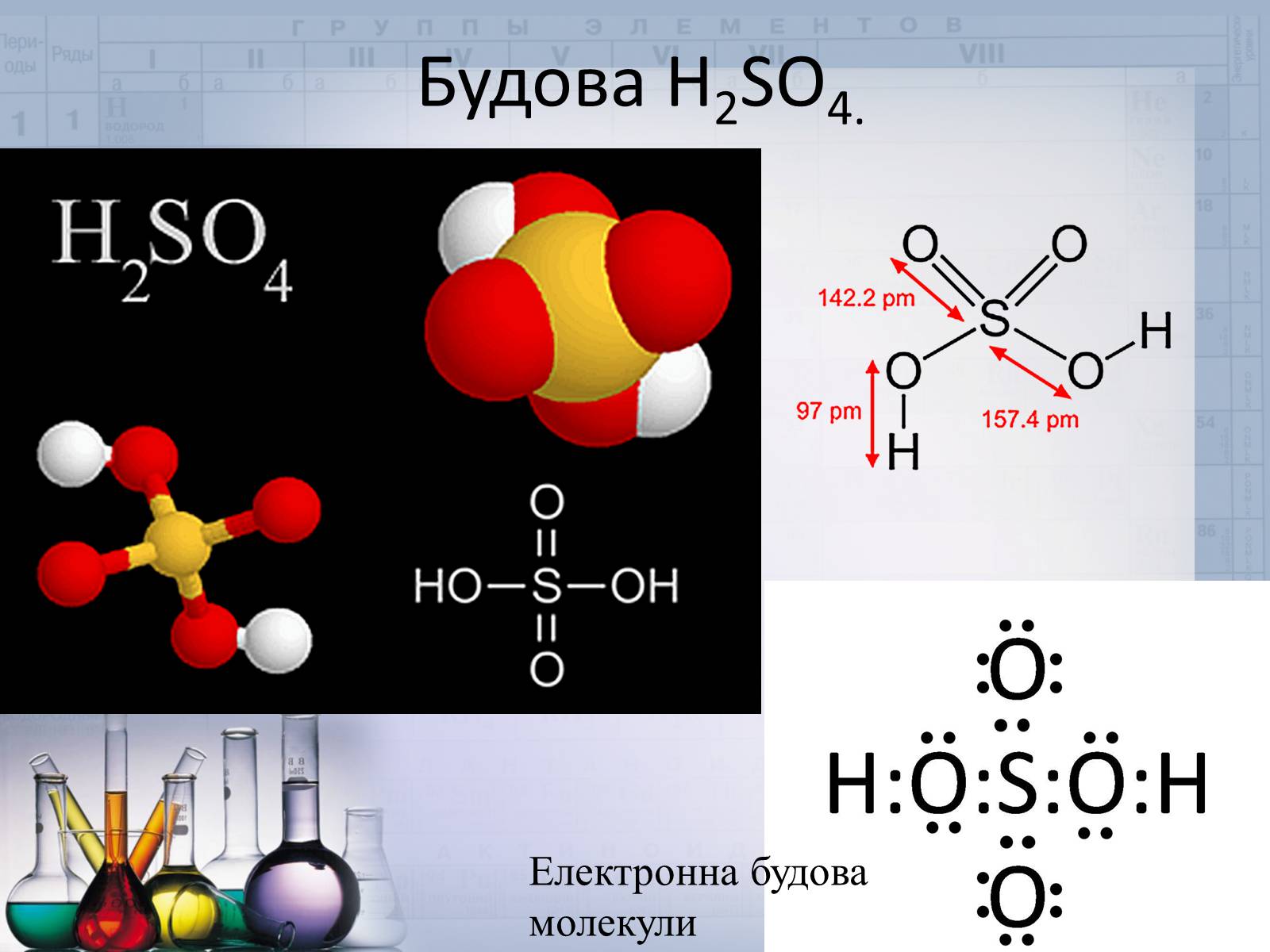
Будова H2SO4.
Електронна будова молекули
Електронна будова молекули
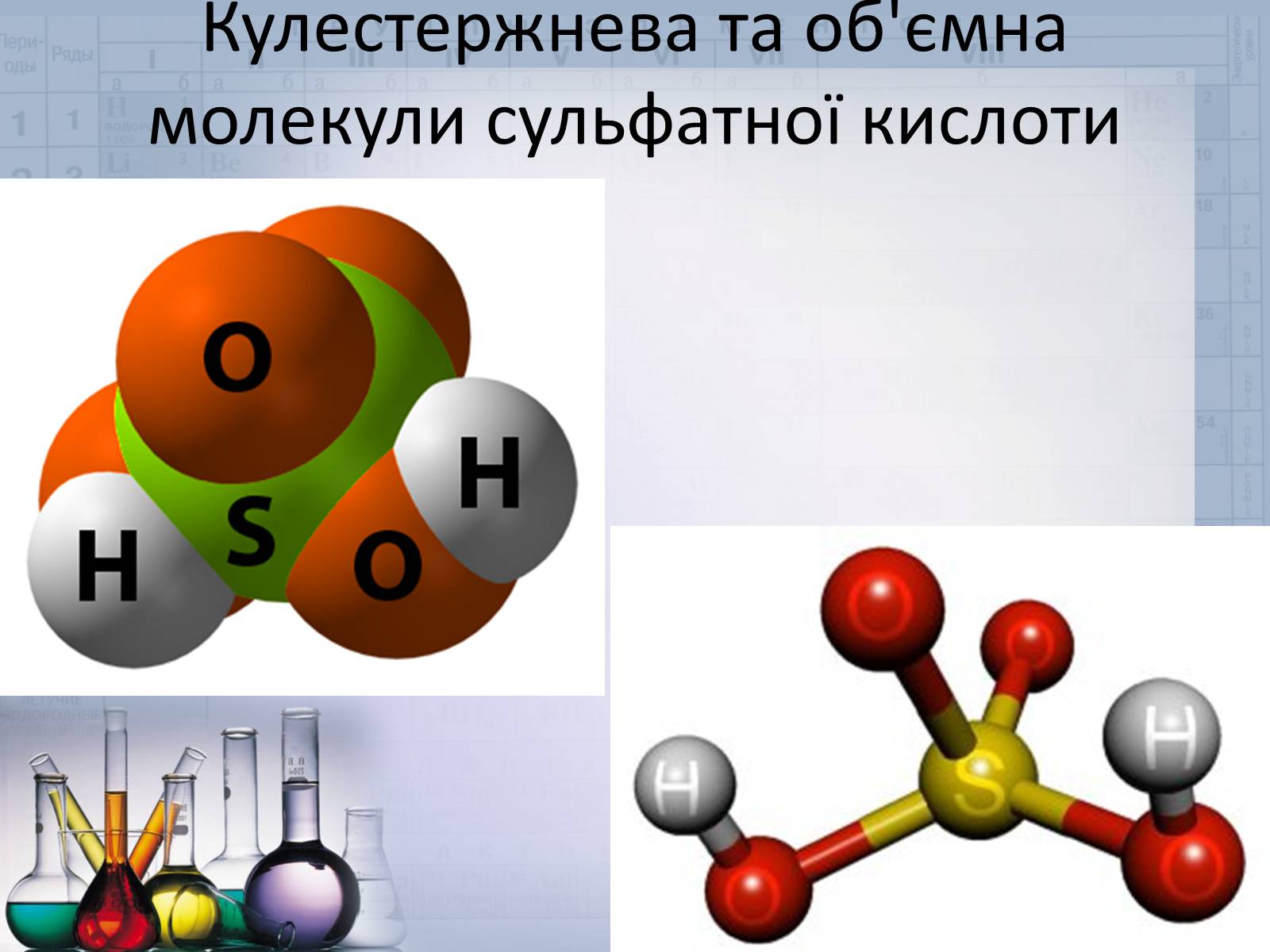
Слайд #10
Кулестержнева та об'ємна молекули сульфатної кислоти
Слайд #11
Одержання сульфатної кислоти.
Найбільше значення має контактний спосіб одержання сульфатної кислоти. Процес складається з трьох стадій.1) Одержання сульфур(IV) оксиду. Сировиною є сульфурвмісні руди, сірка, сірководень:
4FеS2 + 11O2 = 2Fе2О3 + 8SO2 ; ΔH = -13 476 кДж
2) Окиснення сульфур(IV) оксиду в сульфур(VI) оксид:
2SO2 + O2 → 2SO3, ΔH = -197,9 кДж.
(реакція йде під тиском, при підвищеній температурі й у присутності каталізаторів V2O5).
3) Одержання сульфатної кислоти. При цьому сульфур(VI) оксид поглинають розведеною сульфатною кислотою, одержуючи олеум, який потім розбавляють до потрібної концентрації:
SO3 + Н2О = Н2SO4; ΔH = -130,6 кДж
nSO3 + H2SO4 H2SO4·nSO3
Найбільше значення має контактний спосіб одержання сульфатної кислоти. Процес складається з трьох стадій.1) Одержання сульфур(IV) оксиду. Сировиною є сульфурвмісні руди, сірка, сірководень:
4FеS2 + 11O2 = 2Fе2О3 + 8SO2 ; ΔH = -13 476 кДж
2) Окиснення сульфур(IV) оксиду в сульфур(VI) оксид:
2SO2 + O2 → 2SO3, ΔH = -197,9 кДж.
(реакція йде під тиском, при підвищеній температурі й у присутності каталізаторів V2O5).
3) Одержання сульфатної кислоти. При цьому сульфур(VI) оксид поглинають розведеною сульфатною кислотою, одержуючи олеум, який потім розбавляють до потрібної концентрації:
SO3 + Н2О = Н2SO4; ΔH = -130,6 кДж
nSO3 + H2SO4 H2SO4·nSO3

Слайд #12
Фізичні властивості.
За звичайних умов чиста сульфатна кислота — безбарвна оліїста рідина без запаху, ρ = 1,83 г/см3.
Нерозбавлена кислота важка: 1 літр важить майже 2 кг.
Температура плавлення сполуки становить +10,3 °С, а кипіння +280 °С. Під час кипіння кислота починає розкладатися на сульфур(VI) оксид і воду.
Сульфатна кислота необмежено розчиняється у воді, тобто змішується з нею в будь яких співвідношеннях з утворенням розчину. При цьому виділяється тепло.
За звичайних умов чиста сульфатна кислота — безбарвна оліїста рідина без запаху, ρ = 1,83 г/см3.
Нерозбавлена кислота важка: 1 літр важить майже 2 кг.
Температура плавлення сполуки становить +10,3 °С, а кипіння +280 °С. Під час кипіння кислота починає розкладатися на сульфур(VI) оксид і воду.
Сульфатна кислота необмежено розчиняється у воді, тобто змішується з нею в будь яких співвідношеннях з утворенням розчину. При цьому виділяється тепло.

Слайд #13
При розчиненні сірчаної кислоти у воді виділяється велика кількість тепла (19 ккал на моль кислоти) унаслідок утворення гідратів.

Слайд #14
При розчиненні сірчаної кислоти у воді виділяється велика кількість тепла (19 ккал на моль кислоти) унаслідок утворення гідратів.

Слайд #15
Здатністю поглинати воду пояснюється і обвуглювання багатьох органічних речовин, вуглеводів (целюлоза, цукор і ін.). Сірчана кислота віднімає від вуглеводів елементи води, а вуглець виділяється у вигляді вугілля.
Концентрована сульфатна кислота руйнує рослинні і тваринні організми, і працювати з нею слід дуже обережно.
Сульфатна кислота — їдка рідина, тому треба остерігатись, щоб вона не потрапила на шкіру й одяг.
Концентрована сульфатна кислота руйнує рослинні і тваринні організми, і працювати з нею слід дуже обережно.
Сульфатна кислота — їдка рідина, тому треба остерігатись, щоб вона не потрапила на шкіру й одяг.

Слайд #16
При попаданні сірчаної кислоти на шкіру її необхідно швидко змити сильним струменем води та обробити 5%-им розчином соди.

Слайд #17
Хімічні властивості H2SO4
Дисоціація у водному розчині. Змінює колір індикатора
Н2SO4 ↔ Н+ + НSO4-
НSO4- ↔ Н+ + SО42-
Нейтралізації (з основами)
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
З оксидами металів
H2SO4 + CuO = CuSO4 + H2O
Розведена сульфатна кислота реагує лише з металами, що стоять і ряді напруг до Гідрогену:
Zn + H2SO4 = ZnSO4 + H2
З солями
H2SO4 + ВaCl2 = ВaSO4 + 2HCl
Дисоціація у водному розчині. Змінює колір індикатора
Н2SO4 ↔ Н+ + НSO4-
НSO4- ↔ Н+ + SО42-
Нейтралізації (з основами)
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
З оксидами металів
H2SO4 + CuO = CuSO4 + H2O
Розведена сульфатна кислота реагує лише з металами, що стоять і ряді напруг до Гідрогену:
Zn + H2SO4 = ZnSO4 + H2
З солями
H2SO4 + ВaCl2 = ВaSO4 + 2HCl

Слайд #18
Продукти взаємодії концентрованої сульфатної кислоти з металами
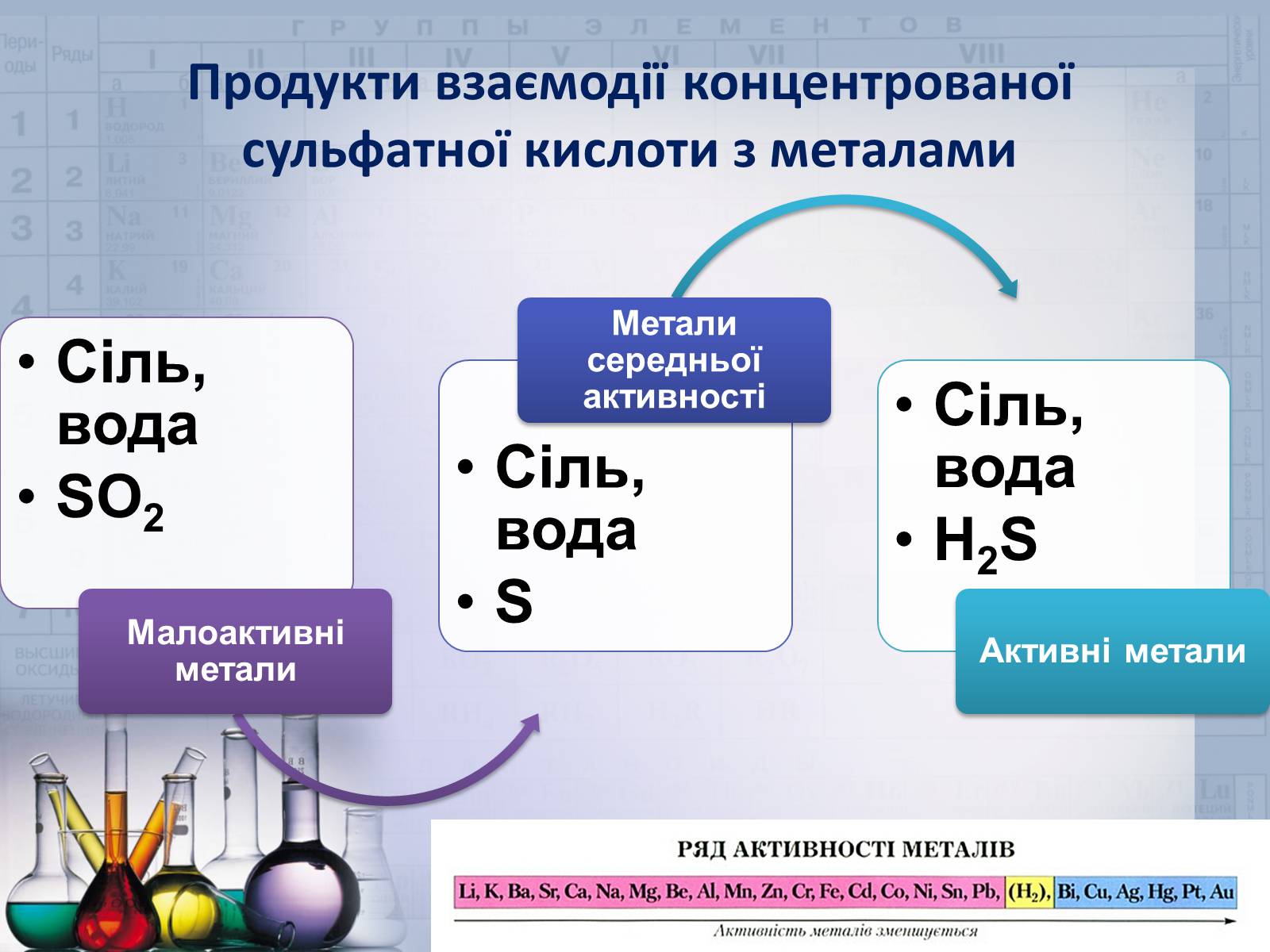
Слайд #19
Продукти взаємодії концентрованої сульфатної кислоти з металами

Слайд #20
Сульфатна кислота при взаємодії з оксидом міді утворює сульфат міді з характерним блакитним забарвленням
H2SO4 + CuO = CuSO4 + H2O
H2SO4 + CuO = CuSO4 + H2O

Слайд #21
Основною умовою проходження реакцій з солями є утворення осаду або газу. Якісною реакцією на сульфат-іон є взаємодія з іоном барію, в результаті чого утворюється характерний білий осад:
H2SO4 + ВaCl2 = ВaSO4↓ + 2HCl
H2SO4 + ВaCl2 = ВaSO4↓ + 2HCl

Слайд #22
Спорідненість сірчаної кислоти до води настільки велика,що вона може служити дегідратуючим агентом; під дією концентрованої сірчаної кислоти вуглеводи, наприклад сахароза, обвуглюються:
H2SO4 (конц)
C12H22O11(тв) ==== 12С (тв.) 11H2O
H2SO4 (конц)
C12H22O11(тв) ==== 12С (тв.) 11H2O

Слайд #23
Сульфатну кислоту застосовують:
у виробництві мінеральних добрив;
як електроліт в свинцевих акумуляторах;
для добування різних мінеральних кислот і солей;
у виробництві хімічних волокон, барвників, димотворних речовин і вибухових речовин;
у нафтовій, металообробній, текстильній, шкіряній і ін. галузях промисловості;
у харчовій промисловості — зареєстрована як харчова добавка E513(емульгатор);
у промисловому органічному синтезі
у виробництві мінеральних добрив;
як електроліт в свинцевих акумуляторах;
для добування різних мінеральних кислот і солей;
у виробництві хімічних волокон, барвників, димотворних речовин і вибухових речовин;
у нафтовій, металообробній, текстильній, шкіряній і ін. галузях промисловості;
у харчовій промисловості — зареєстрована як харчова добавка E513(емульгатор);
у промисловому органічному синтезі

Слайд #24
На 1 т фосфорних добрив витрачається 2,2-3,4 т сірчаної кислоти, а на 1 т амонійних — 0,75 т сірчаної кислоти.

Слайд #25
Охорона праці та навколишнього середовища у виробництві сульфатної кислоти.
У виробництві сульфатної кислоти можуть бути втрати якоїсь кількості діоксиду SO2 і триоксиду сульфуру SO3 та викидання їх в атмосферу, що спричинює кислотні дощі.
Вони сприяють підвищенню кислотності ґрунтів і зниженню врожаїв, збільшенню кислотності водойм і загибелі його мешканців.
Найдрібніші крапельки сірчаної кислоти можуть утворюватися в середніх і верхніх шарах атмосфери в результаті реакції водяної пари і вулканічного попелу, що містить великі кількості сірки. Суспензія, що утворилася, затрудняє доступ сонячних променів до поверхні планети.
Кислотні дощі спричинюють корозію металів, руйнують лакофарбові покриття.
Під їх згубною дією руйнуються будівельні матеріали, пам'ятники архітектури.
У виробництві сульфатної кислоти можуть бути втрати якоїсь кількості діоксиду SO2 і триоксиду сульфуру SO3 та викидання їх в атмосферу, що спричинює кислотні дощі.
Вони сприяють підвищенню кислотності ґрунтів і зниженню врожаїв, збільшенню кислотності водойм і загибелі його мешканців.
Найдрібніші крапельки сірчаної кислоти можуть утворюватися в середніх і верхніх шарах атмосфери в результаті реакції водяної пари і вулканічного попелу, що містить великі кількості сірки. Суспензія, що утворилася, затрудняє доступ сонячних променів до поверхні планети.
Кислотні дощі спричинюють корозію металів, руйнують лакофарбові покриття.
Під їх згубною дією руйнуються будівельні матеріали, пам'ятники архітектури.

Слайд #26
Охорона праці та навколишнього середовища у виробництві сульфатної кислоти.
У виробництві сульфатної кислоти можуть бути втрати якоїсь кількості діоксиду SO2 і триоксиду сульфуру SO3 та викидання їх в атмосферу, що спричинює кислотні дощі.
Вони сприяють підвищенню кислотності ґрунтів і зниженню врожаїв, збільшенню кислотності водойм і загибелі його мешканців.
Найдрібніші крапельки сірчаної кислоти можуть утворюватися в середніх і верхніх шарах атмосфери в результаті реакції водяної пари і вулканічного попелу, що містить великі кількості сірки. Суспензія, що утворилася, затрудняє доступ сонячних променів до поверхні планети.
Кислотні дощі спричинюють корозію металів, руйнують лакофарбові покриття.
Під їх згубною дією руйнуються будівельні матеріали, пам'ятники архітектури.
У виробництві сульфатної кислоти можуть бути втрати якоїсь кількості діоксиду SO2 і триоксиду сульфуру SO3 та викидання їх в атмосферу, що спричинює кислотні дощі.
Вони сприяють підвищенню кислотності ґрунтів і зниженню врожаїв, збільшенню кислотності водойм і загибелі його мешканців.
Найдрібніші крапельки сірчаної кислоти можуть утворюватися в середніх і верхніх шарах атмосфери в результаті реакції водяної пари і вулканічного попелу, що містить великі кількості сірки. Суспензія, що утворилася, затрудняє доступ сонячних променів до поверхні планети.
Кислотні дощі спричинюють корозію металів, руйнують лакофарбові покриття.
Під їх згубною дією руйнуються будівельні матеріали, пам'ятники архітектури.

Слайд #27
Найдрібніші крапельки сірчаної кислоти можуть утворюватися в середніх і верхніх шарах атмосфери в результаті реакції водяної пари і вулканічного попелу, що містить великі кількості сірки. Суспензія, що утворилася, затрудняє доступ сонячних променів до поверхні планети.

Слайд #28
Восьме чудо світу - так називають індонезійці озера на острові Флорес. Для того що б побачити ці водоймища, потрібно піднятися на гориу Келиму-ту, з якої відкривається незабутнє видовище: з одного боку - озеро криваво-червоного кольору, з іншого боку -голубувато-зеленого , а з третього видніється озеро з водою білою, як молоко... Різне забарвлення їх водам додають розчинені солі мінералів. У червоний колір воду забарвлюють сполуки заліза, в білий і голубувато-зелений - різні сполуки сірки.

Слайд #29
Озеро смерті, що знаходиться на острові Сицілія, — саме "мертве" на Землі. Береги озера позбавлені рослинності, а в його водах немає нічого живого. Будь – яка істота, що потрапила в його води, миттєво гине. Коли був зроблений аналіз води, то виявилось, що в ній у великій кількості міститься сірчана кислота.

Слайд #30
Найбільшим родовищем сульфату натрію є затока Кара-Богаз-гол. Вона розташований на східному березі Каспійського моря.

Слайд #31
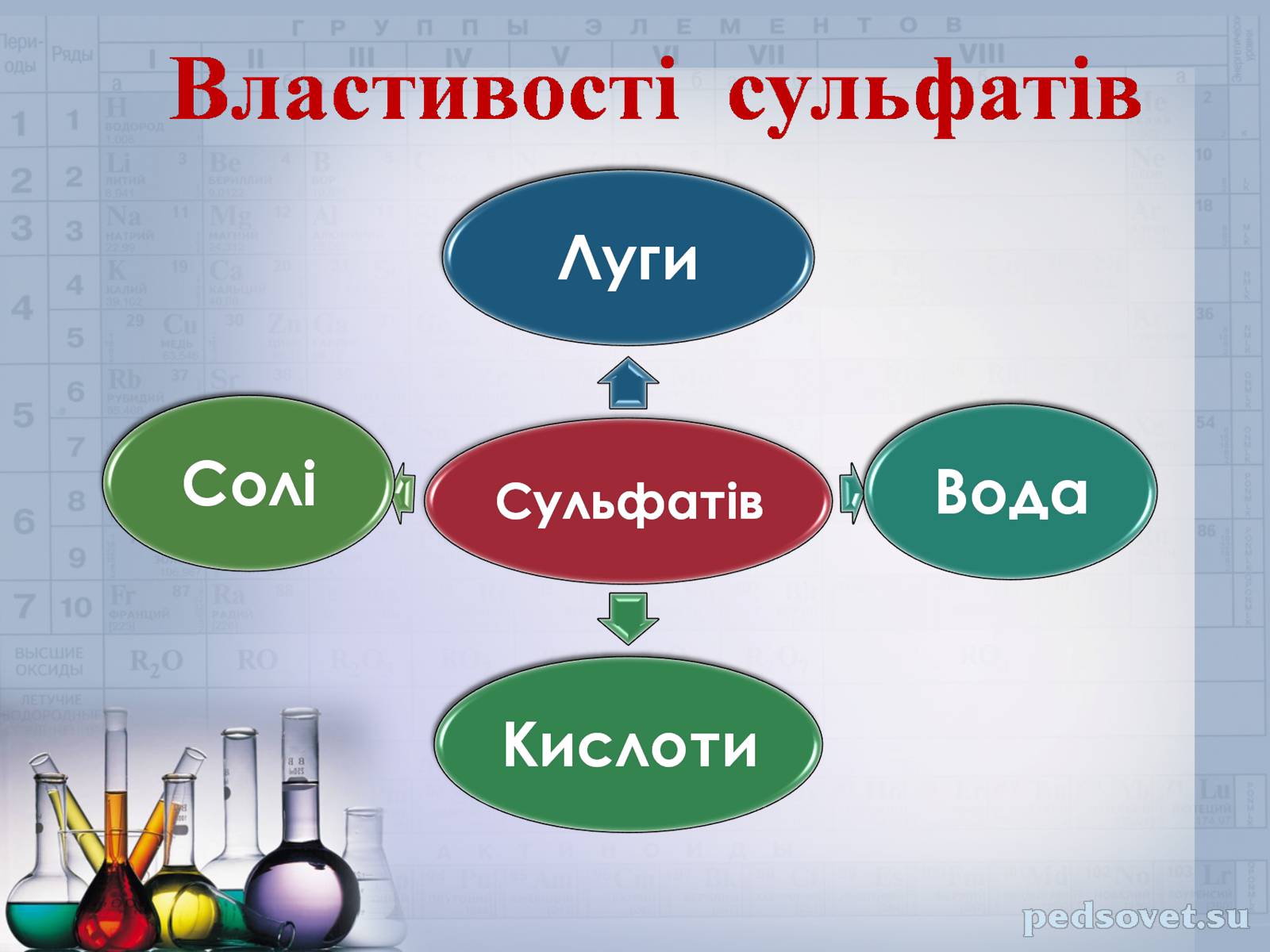
Сульфати
Солі сульфатної кислоти називаються сульфати
Солі сульфатної кислоти називаються сульфати

Слайд #32
Сульфати
Солі сульфатної кислоти називаються сульфати
Солі сульфатної кислоти називаються сульфати
Слайд #33
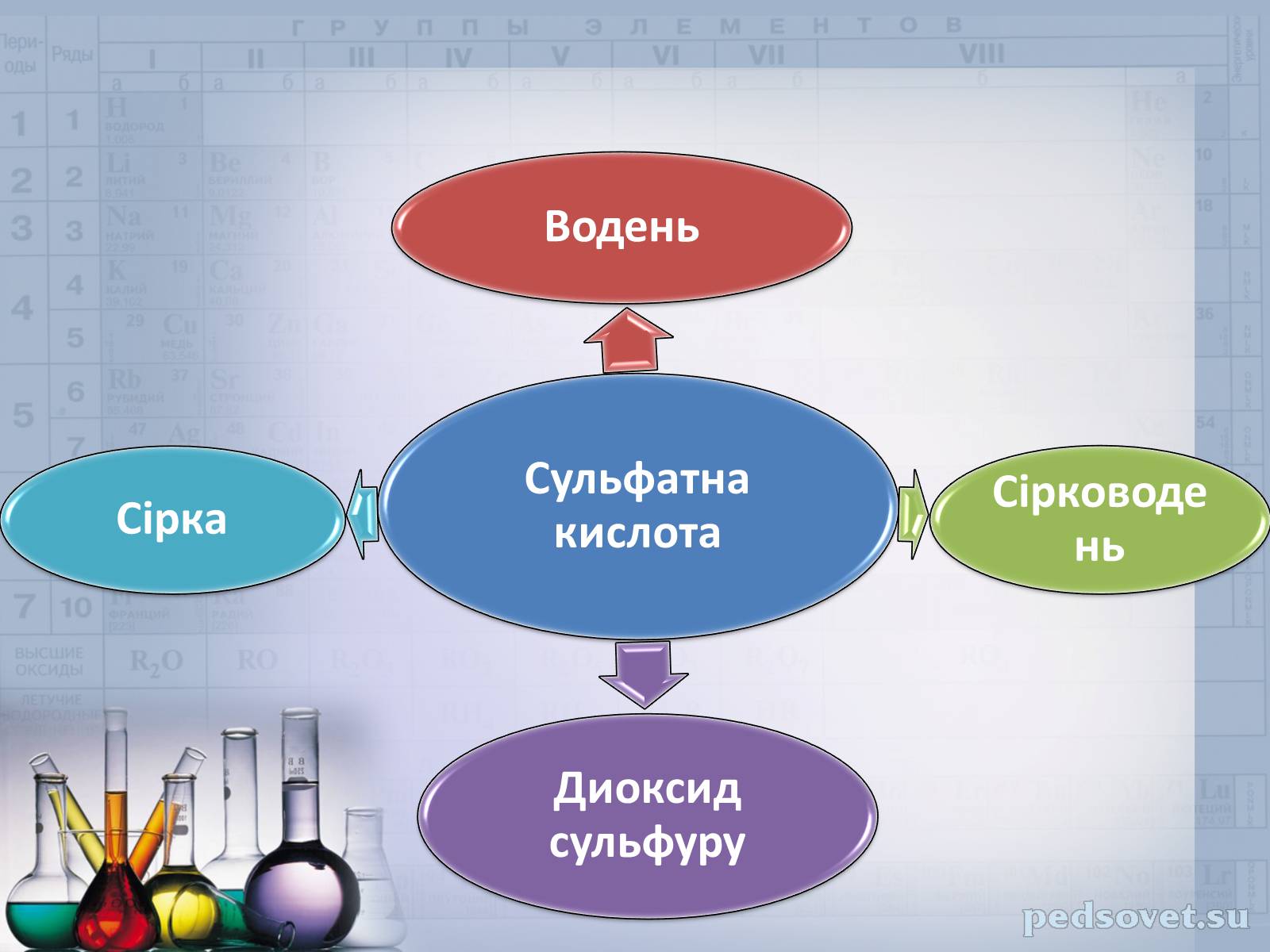
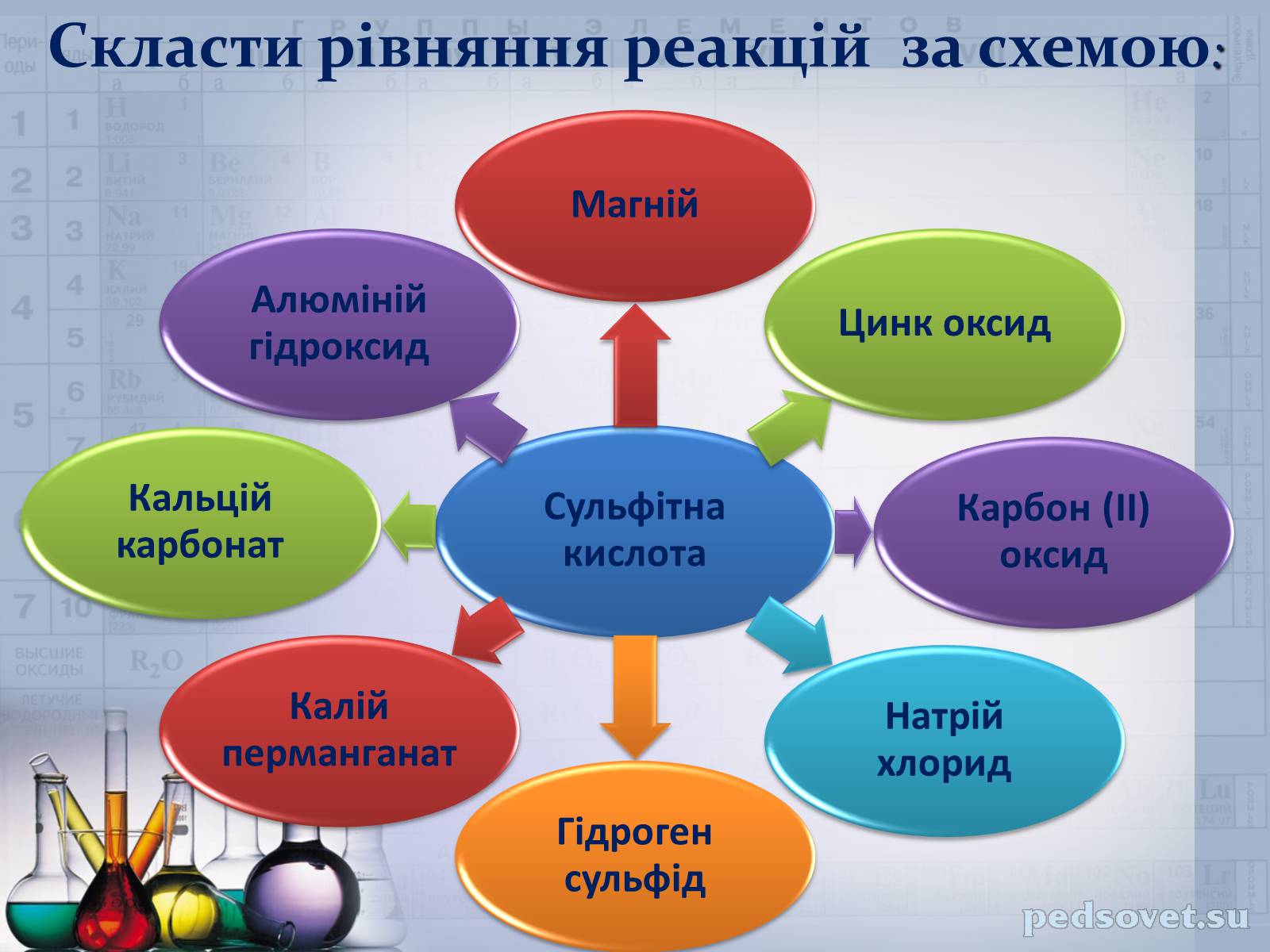
Скласти рівняння реакцій за схемою:
Слайд #34
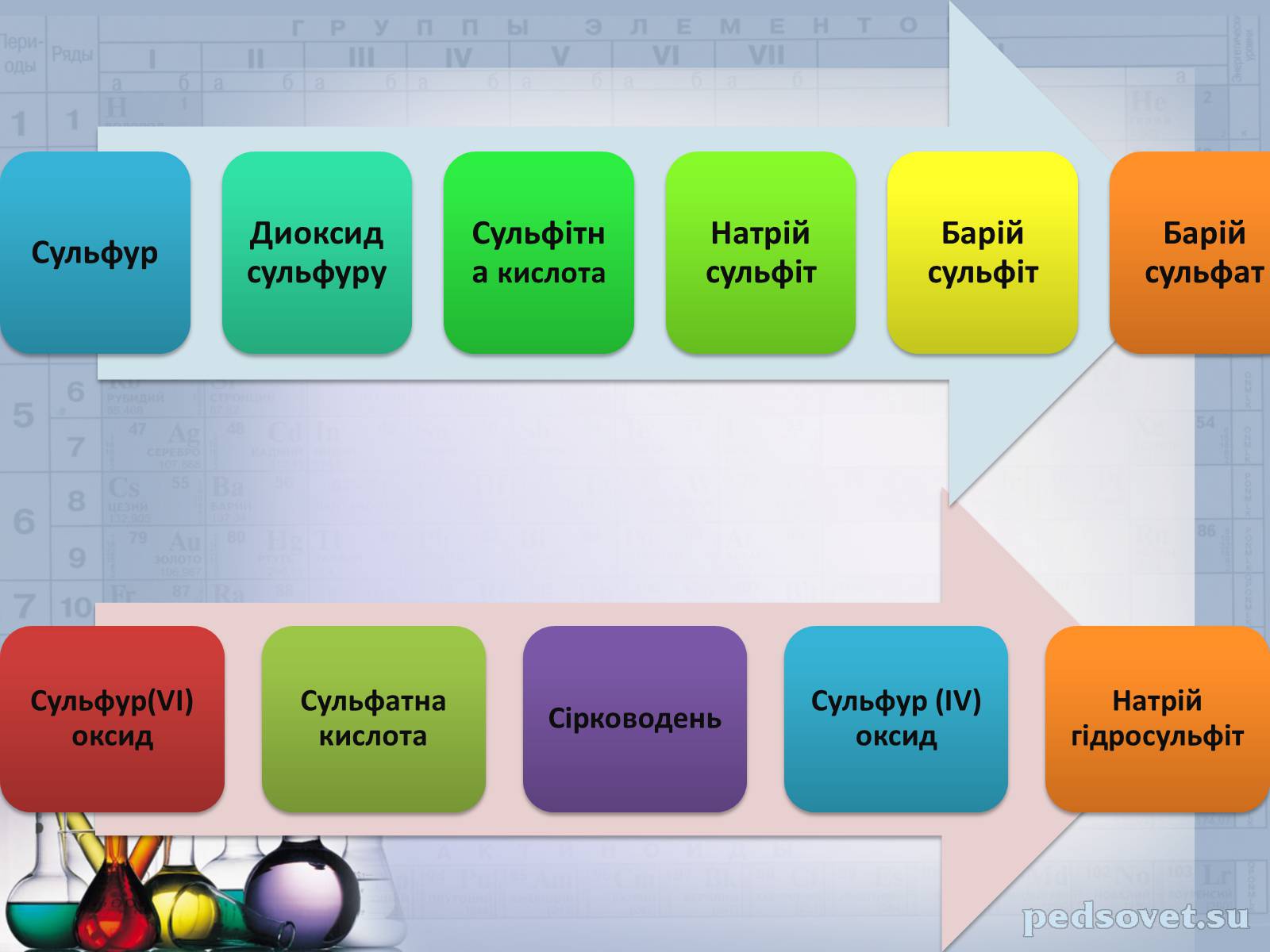
Скласти рівняння реакцій за схемою:
Слайд #35