- Головна
- Готові шкільні презентації
- Презентація на тему «Лужні метали» (варіант 2)
Презентація на тему «Лужні метали» (варіант 2)
1243
Слайд #1
Лужні метали
Властивості, будова, застосування.
Властивості, будова, застосування.

Слайд #2
Місце в періодичній системі
Лужні метали – елементи І групи , головної підгрупи періодичної системи.
Назва пов'язана з тим, що при взаємодії лужних металів з водою утворюється їдкий луг. До лужних металів належать :
Літій (Li)
Натрій (Na)
Калій (K)
Рубідій (Rb)
Цезій (Cs)
Францій (Fr)
Лужні метали – елементи І групи , головної підгрупи періодичної системи.
Назва пов'язана з тим, що при взаємодії лужних металів з водою утворюється їдкий луг. До лужних металів належать :
Літій (Li)
Натрій (Na)
Калій (K)
Рубідій (Rb)
Цезій (Cs)
Францій (Fr)

Слайд #3
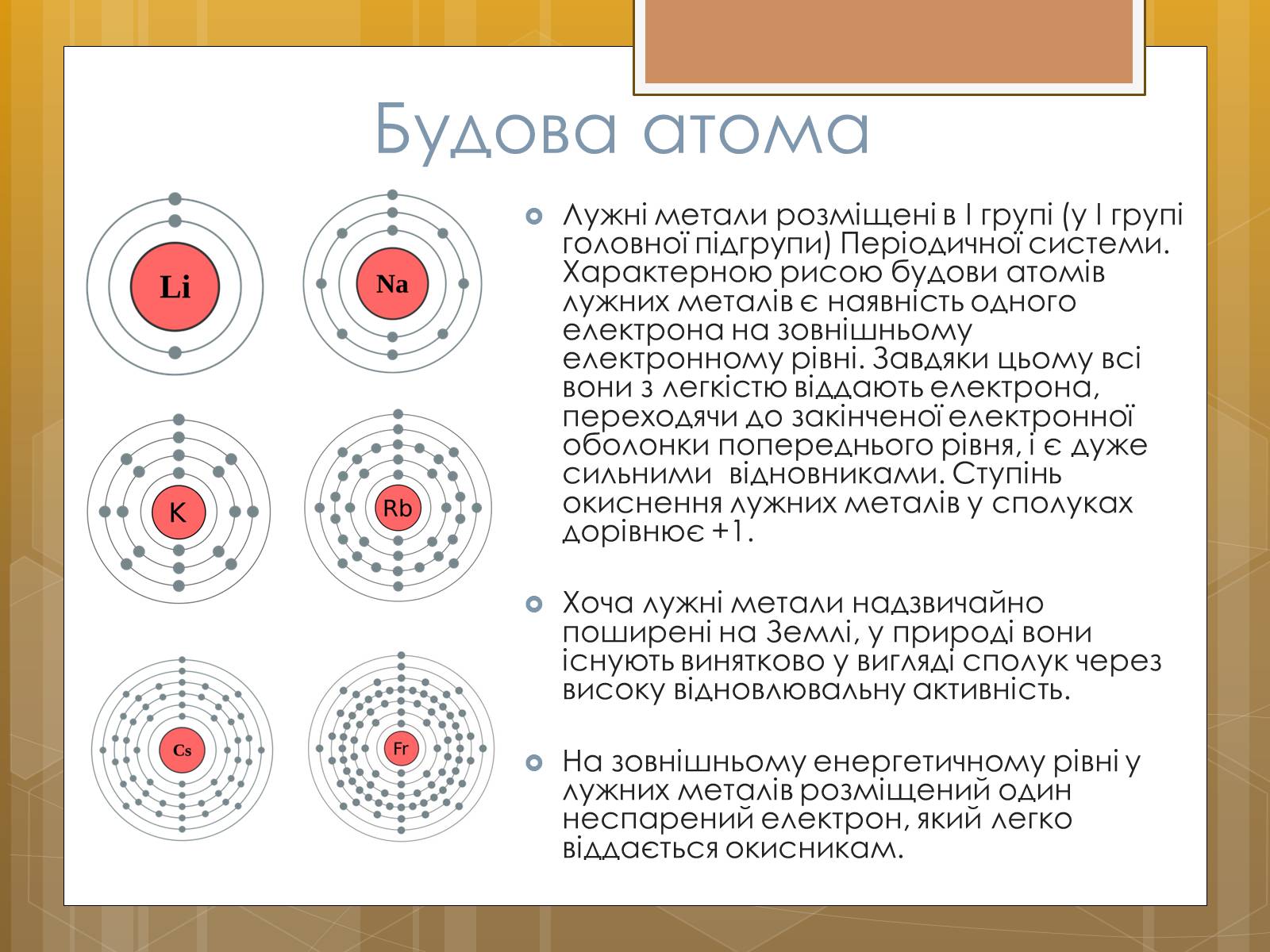
Будова атома
Лужні метали розміщені в I групі (у I групі головної підгрупи) Періодичної системи. Характерною рисою будови атомів лужних металів є наявність одного електрона на зовнішньому електронному рівні. Завдяки цьому всі вони з легкістю віддають електрона, переходячи до закінченої електронної оболонки попереднього рівня, і є дуже сильними відновниками. Ступінь окиснення лужних металів у сполуках дорівнює +1.
Хоча лужні метали надзвичайно поширені на Землі, у природі вони існують винятково у вигляді сполук через високу відновлювальну активність.
На зовнішньому енергетичному рівні у лужних металів розміщений один неспарений електрон, який легко віддається окисникам.
Лужні метали розміщені в I групі (у I групі головної підгрупи) Періодичної системи. Характерною рисою будови атомів лужних металів є наявність одного електрона на зовнішньому електронному рівні. Завдяки цьому всі вони з легкістю віддають електрона, переходячи до закінченої електронної оболонки попереднього рівня, і є дуже сильними відновниками. Ступінь окиснення лужних металів у сполуках дорівнює +1.
Хоча лужні метали надзвичайно поширені на Землі, у природі вони існують винятково у вигляді сполук через високу відновлювальну активність.
На зовнішньому енергетичному рівні у лужних металів розміщений один неспарений електрон, який легко віддається окисникам.
Слайд #4
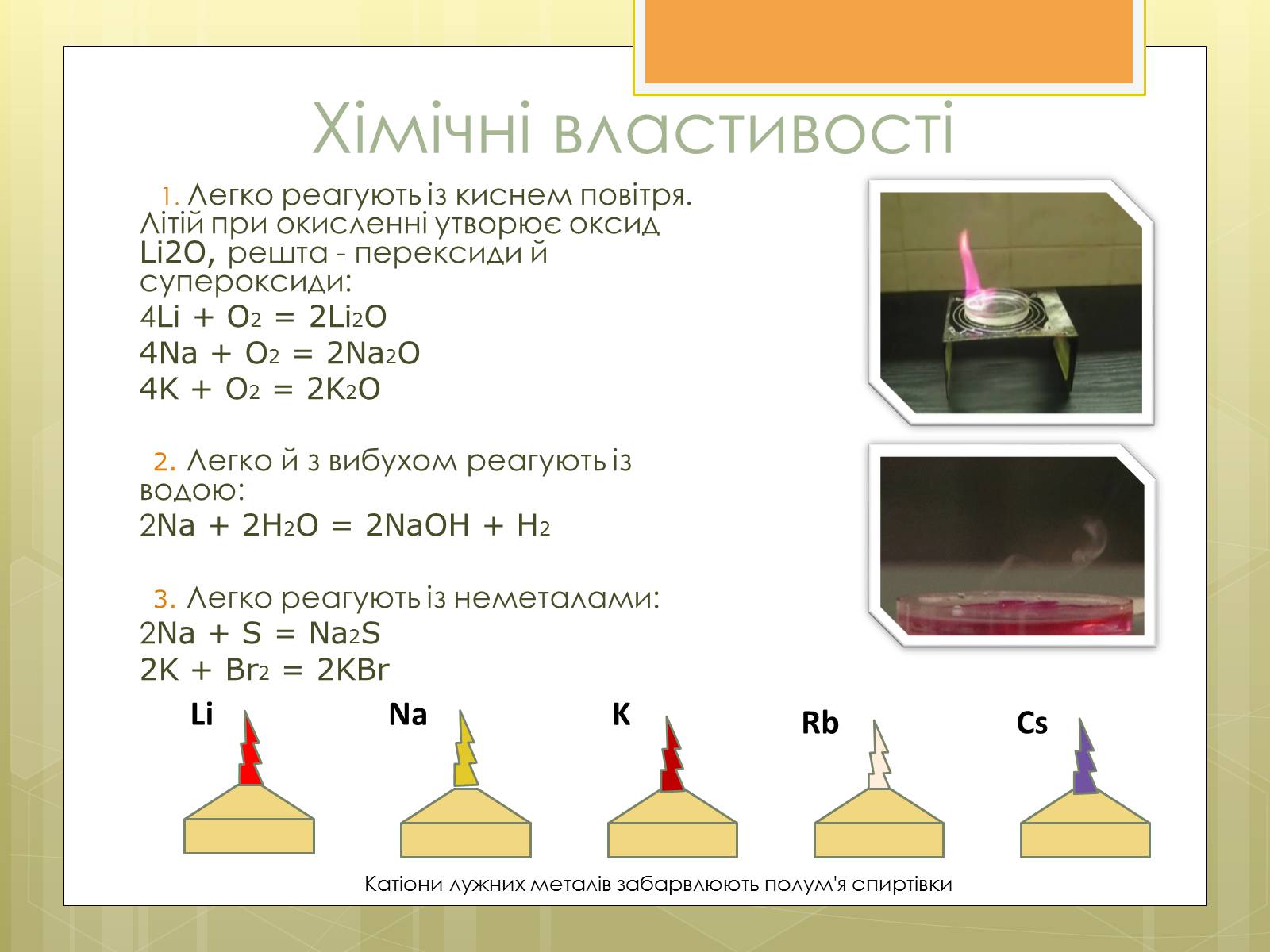
Хімічні властивості
1. Легко реагують із киснем повітря. Літій при окисленні утворює оксид Li2O, решта - перексиди й супероксиди:
4Li + O2 = 2Li2O
4Na + O2 = 2Na2O
4K + O2 = 2K2O
2. Легко й з вибухом реагують із водою:
2Na + 2H2O = 2NaOH + H2
3. Легко реагують із неметалами:
2Na + S = Na2S
2K + Br2 = 2KBr
Na
K
Rb
Cs
Li
Катіони лужних металів забарвлюють полум'я спиртівки
1. Легко реагують із киснем повітря. Літій при окисленні утворює оксид Li2O, решта - перексиди й супероксиди:
4Li + O2 = 2Li2O
4Na + O2 = 2Na2O
4K + O2 = 2K2O
2. Легко й з вибухом реагують із водою:
2Na + 2H2O = 2NaOH + H2
3. Легко реагують із неметалами:
2Na + S = Na2S
2K + Br2 = 2KBr
Na
K
Rb
Cs
Li
Катіони лужних металів забарвлюють полум'я спиртівки
Слайд #5
Хімічні властивості
Реагують
Прості речовини
Складні речовини
Галогени
Реагують
Прості речовини
Складні речовини
Галогени
Слайд #6
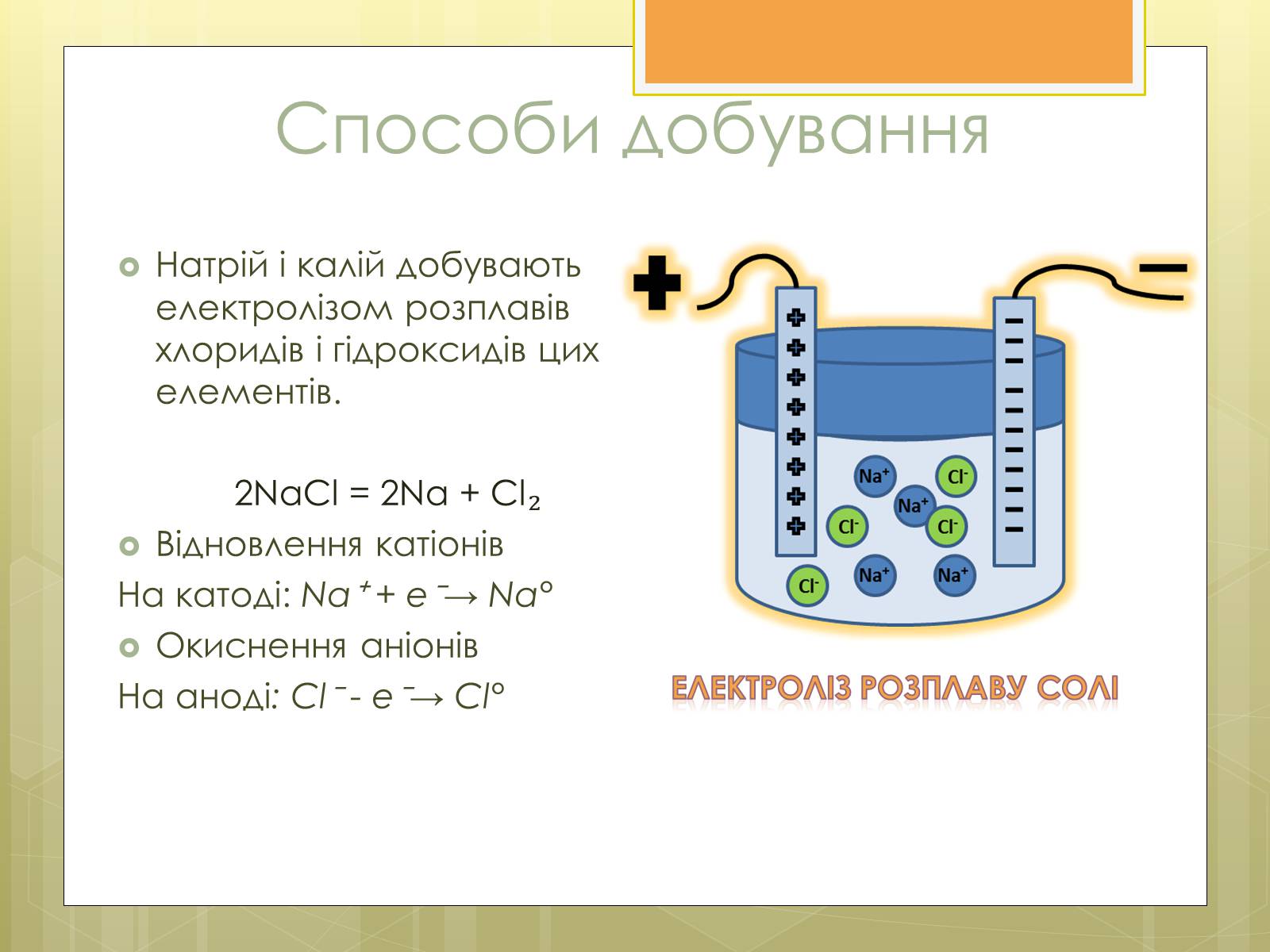
Способи добування
Натрій і калій добувають електролізом розплавів хлоридів і гідроксидів цих елементів.
2NaCl = 2Na + Cl₂
Відновлення катіонів
На катоді: Na⁺ + e⁻→ Na°
Окиснення аніонів
На аноді: Cl⁻ - e⁻→ Cl°
електроліз розплаву солі
Натрій і калій добувають електролізом розплавів хлоридів і гідроксидів цих елементів.
2NaCl = 2Na + Cl₂
Відновлення катіонів
На катоді: Na⁺ + e⁻→ Na°
Окиснення аніонів
На аноді: Cl⁻ - e⁻→ Cl°
електроліз розплаву солі
Слайд #7
Фізичні властивості
Лужні метали — м'які (натрій ріжеться ножем, як вершкове масло, інші трохи жорсткіші) метали від сріблисто-білого до сірого кольору з характерним блиском, що дуже швидко тьмяніють на повітрі.
Li
Na
K
Rb
Cs
Fr
Легкоплавкі й рухливі. Агресивні, вибухонебезпечні (зберігаються під шаром гасу (керосин))
Лужні метали — м'які (натрій ріжеться ножем, як вершкове масло, інші трохи жорсткіші) метали від сріблисто-білого до сірого кольору з характерним блиском, що дуже швидко тьмяніють на повітрі.
Li
Na
K
Rb
Cs
Fr
Легкоплавкі й рухливі. Агресивні, вибухонебезпечні (зберігаються під шаром гасу (керосин))

Слайд #8
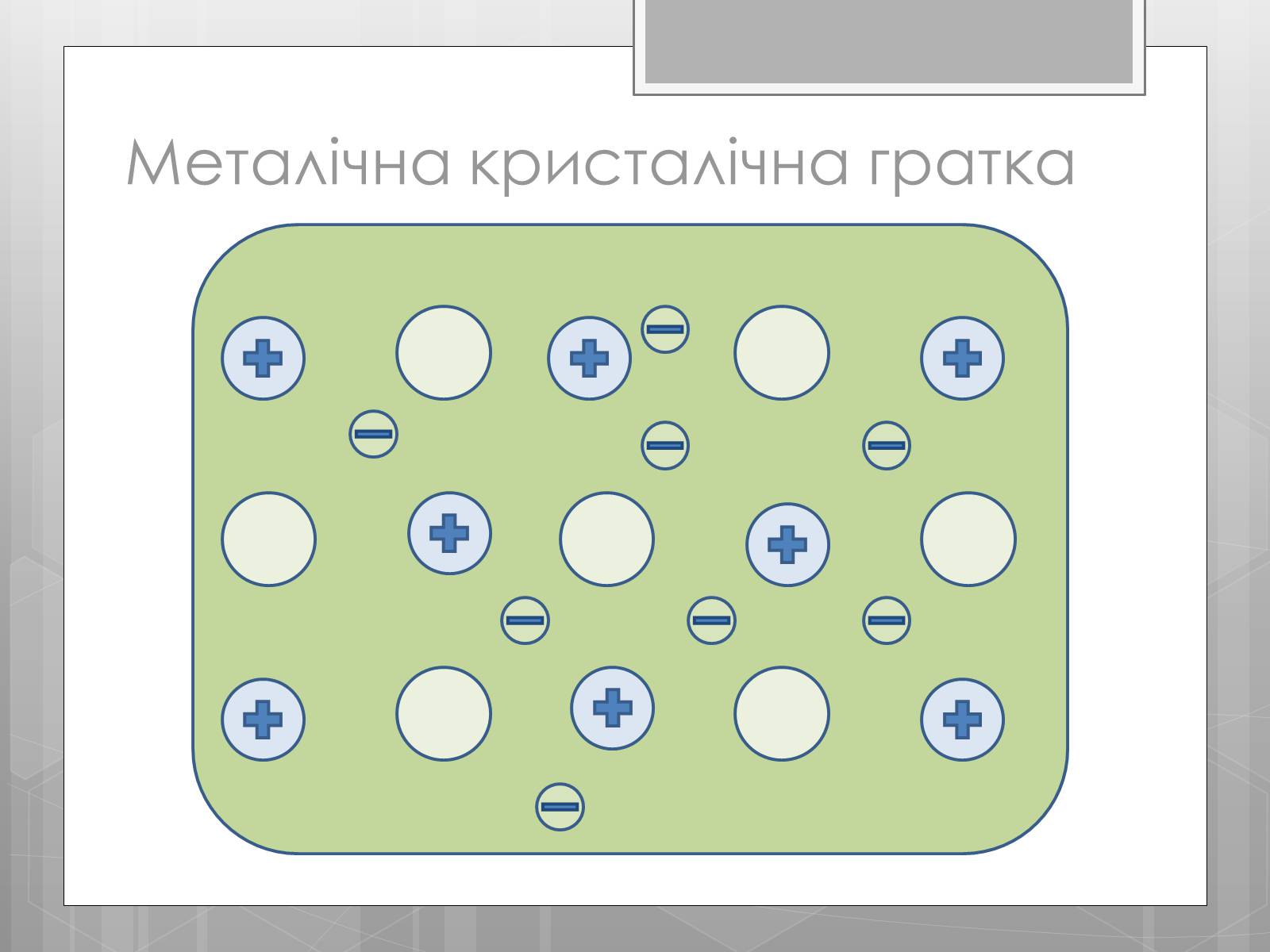
Металічна кристалічна гратка
Слайд #9
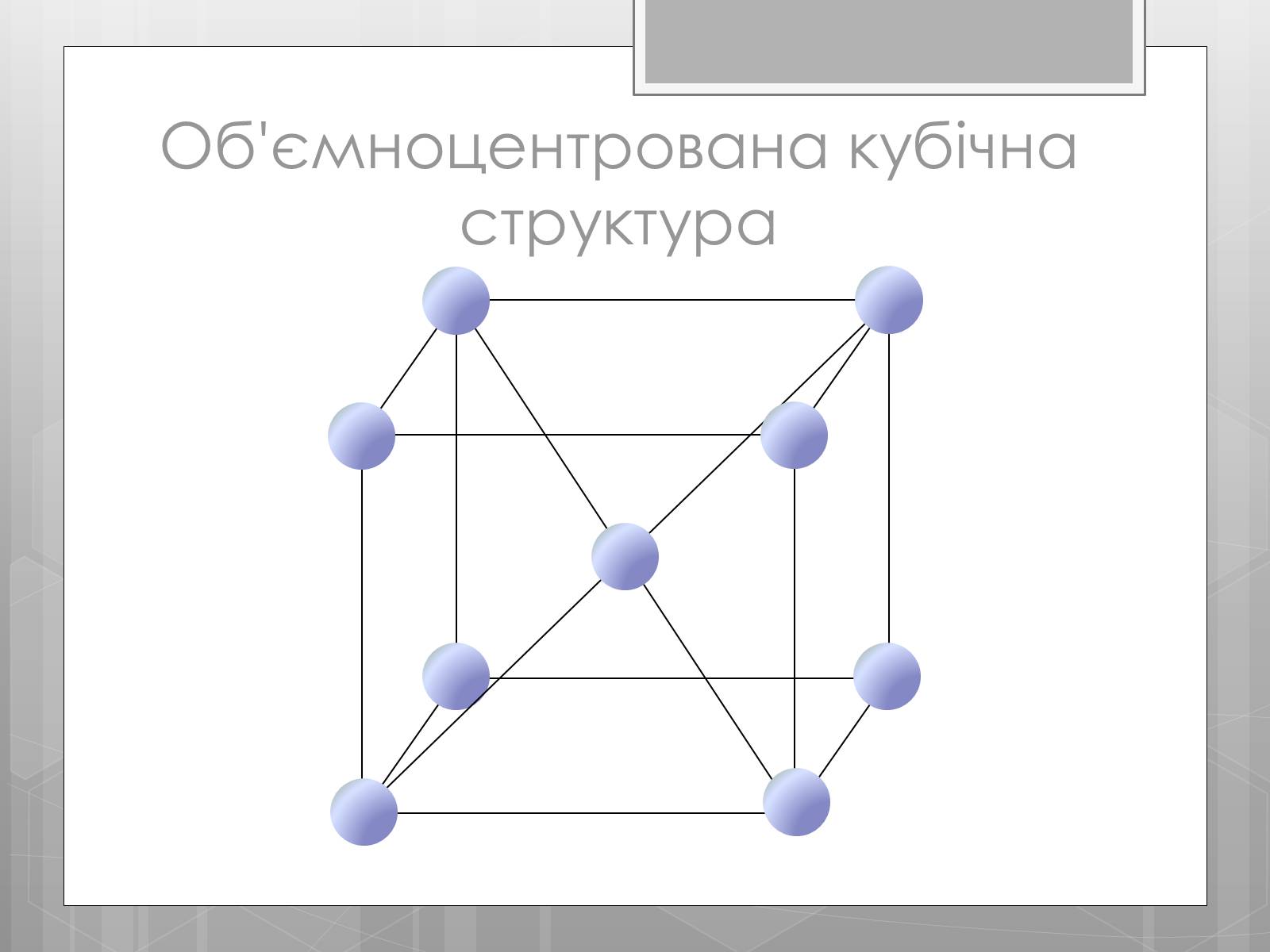
Об'ємноцентрована кубічна структура
Слайд #10
Поширення в природі
У природі лужні елементи трапляються лише у вигляді солей. Найважливішими мінералами Натрію є кам'яна сіль або галіт NaCl, чилійська селітра NaNO3, глауберова сіль або мірабіліт Na2SO4 • 10H2O.
Велика кількість солей Натрію кристалізується при випаровуванні морської води. Масова частка Натрію у земній корі становить 2,6 %.
Калій, як і Натрій, є досить розповсюдженим хімічним елементом. Масова частка Калію в земній корі — 2,5%.
Природні солі Калію :
сильвін KCl,
сильвініт КCl ∙ NaCl
карналіт КCl ∙ MgCl2 ∙ 6H2O
Калій входить до складу польових шпатів і слюди.
Літій досить широко поширений в земній корі
польовий шпат
У природі лужні елементи трапляються лише у вигляді солей. Найважливішими мінералами Натрію є кам'яна сіль або галіт NaCl, чилійська селітра NaNO3, глауберова сіль або мірабіліт Na2SO4 • 10H2O.
Велика кількість солей Натрію кристалізується при випаровуванні морської води. Масова частка Натрію у земній корі становить 2,6 %.
Калій, як і Натрій, є досить розповсюдженим хімічним елементом. Масова частка Калію в земній корі — 2,5%.
Природні солі Калію :
сильвін KCl,
сильвініт КCl ∙ NaCl
карналіт КCl ∙ MgCl2 ∙ 6H2O
Калій входить до складу польових шпатів і слюди.
Літій досить широко поширений в земній корі
польовий шпат

Слайд #11
Поширення в природі
У зв'язку з високою хімічною активністю у вільному стані в природі він не зустрічаються, а тільки у вигляді різних сполук. Деякі з них, як хлорид калію, утворюють потужні родовищ
Найбагатші у світі родовища солей калію у вигляді мінералів сильвіну KCl, сильвініту KCl·NaCl, карналіту КCl ∙ MgCl2 ∙ 6H2O і каїніту KCl·MgSO4·3H2O розташовані поблизу м. Солікамська. Крім того, значні поклади сполук калію знайдені в Білорусії (м. Солігорськ) і в Україні (м. Калуш і м. Стебник у Прикарпатті).
хлорид калію
нітрат калію
У зв'язку з високою хімічною активністю у вільному стані в природі він не зустрічаються, а тільки у вигляді різних сполук. Деякі з них, як хлорид калію, утворюють потужні родовищ
Найбагатші у світі родовища солей калію у вигляді мінералів сильвіну KCl, сильвініту KCl·NaCl, карналіту КCl ∙ MgCl2 ∙ 6H2O і каїніту KCl·MgSO4·3H2O розташовані поблизу м. Солікамська. Крім того, значні поклади сполук калію знайдені в Білорусії (м. Солігорськ) і в Україні (м. Калуш і м. Стебник у Прикарпатті).
хлорид калію
нітрат калію

Слайд #12
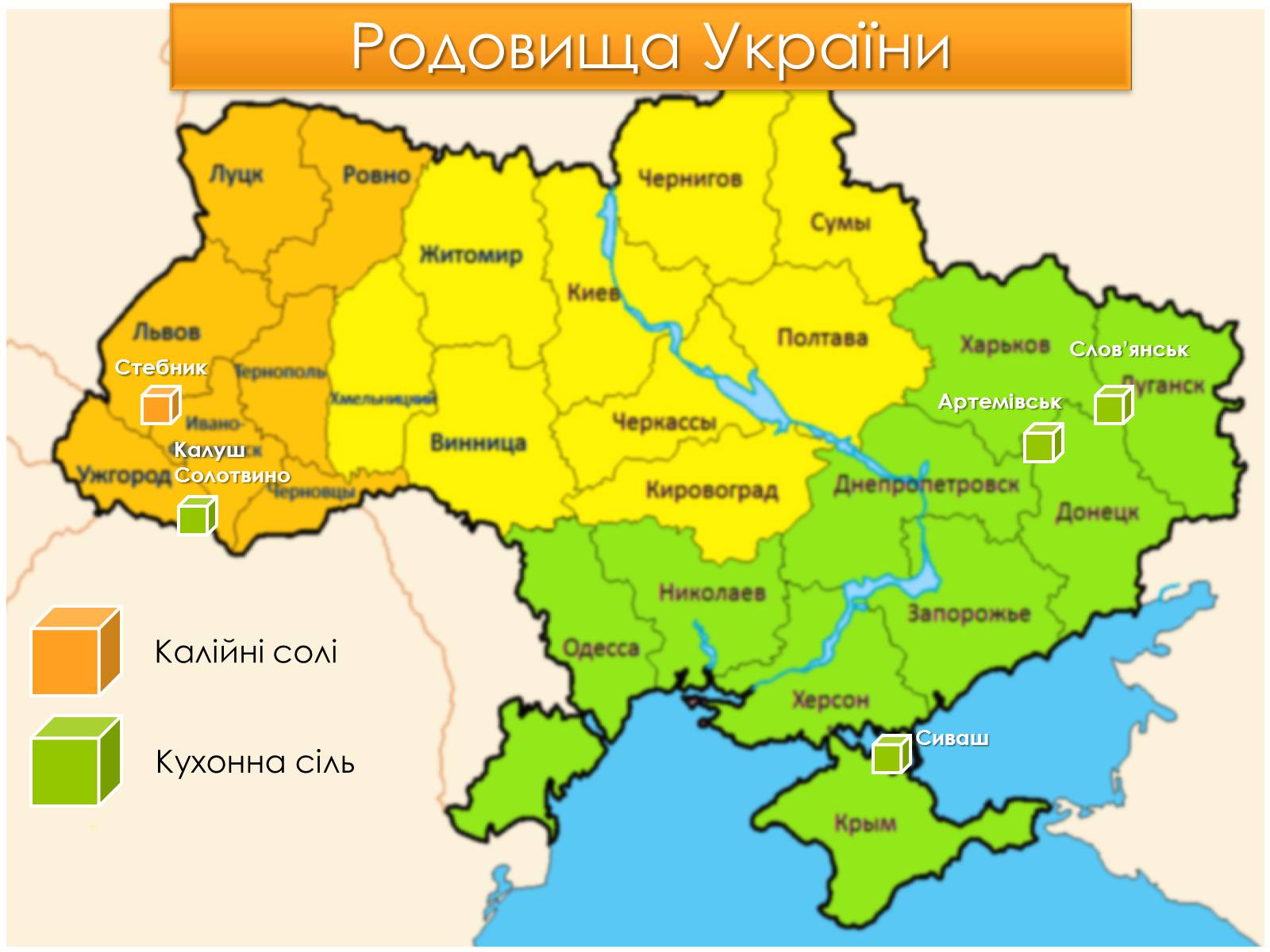
Родовища України
Калійні солі
Кухонна сіль
Стебник
Калуш
Солотвино
Слов'янськ
Артемівськ
Сиваш
Калійні солі
Кухонна сіль
Стебник
Калуш
Солотвино
Слов'янськ
Артемівськ
Сиваш
Слайд #13
Соляні шахти Солотвиного

Слайд #14
Видобуток кухоної солі (Євпаторія)

Слайд #15
Затока Сиваш

Слайд #16
Стебниківський калійний комбінат

Слайд #17
Біологічна роль літію
Літій є умовно-есенціальним мікроелементом.
Це означає, що його біологічна функція відома (або визнана), однак явищ дефіциту літію не спостерігають.
Вміст літію в організмі дорослої людини становить близько 70 мг. Переважно він знаходиться (по зменшенню концентрації) в мозку, печінці, нирках, кістках, серці, легенях.
Біологічна роль літію встановлена не до кінця. За різними джерелами літій може надавати наступні ефекти:
знижує збудливість центральної нервової системи (препарати літію застосовуються в психіатрії)
регулює транспорт натрію в нервових і м'язових клітинах
знижує кількість доступного вільного норадреналіну в центральній нервовій системі
знижує вміст серотоніну в центральній нервовій системі
збільшує чутливість нейронів деяких областей мозку до дії дофаміну
Літій є умовно-есенціальним мікроелементом.
Це означає, що його біологічна функція відома (або визнана), однак явищ дефіциту літію не спостерігають.
Вміст літію в організмі дорослої людини становить близько 70 мг. Переважно він знаходиться (по зменшенню концентрації) в мозку, печінці, нирках, кістках, серці, легенях.
Біологічна роль літію встановлена не до кінця. За різними джерелами літій може надавати наступні ефекти:
знижує збудливість центральної нервової системи (препарати літію застосовуються в психіатрії)
регулює транспорт натрію в нервових і м'язових клітинах
знижує кількість доступного вільного норадреналіну в центральній нервовій системі
знижує вміст серотоніну в центральній нервовій системі
збільшує чутливість нейронів деяких областей мозку до дії дофаміну
Слайд #18
Літій міститься
Найбільш важливими джерелами літію є деякі рослини (томати), риба і морепродукти, а також печінка і легені.
Найбільш важливими джерелами літію є деякі рослини (томати), риба і морепродукти, а також печінка і легені.

Слайд #19
Біологічна роль натрію
Натрій є макроелементом, його вміст в організмі дорослої людини становить близько 150-200 грамів.
Вміст натрію в міжклітинному просторі в 15 разів вище, ніж усередині клітин (різниця забезпечується спеціальним натрій-калієвий насосом).
Обмін регулюється натрію гормонами щитовидної залози: при її недостатності натрій затримується в тканинах, а при гіперфункції натрій посилено виводиться з організму.
Біологічна роль натрію
підтримує осмотичний тиск і рН середовища
разом з калієм формує електричний потенціал мембран клітин, за рахунок якого передається сигнал в нервових клітинах, м'язових клітинах і пр.
бере участь у транспорті через мембрани клітин амінокислот, цукрів, неорганічних і органічних аніонів
бере участь в переносі оксиду вуглецю в крові
посилює виділення нирками різних продуктів метаболізму
бере участь у гідратації білків і розчиненні органічних кислот
бере участь в утворенні шлункового соку
активує ферменти слини і підшлункового соку
Натрій є макроелементом, його вміст в організмі дорослої людини становить близько 150-200 грамів.
Вміст натрію в міжклітинному просторі в 15 разів вище, ніж усередині клітин (різниця забезпечується спеціальним натрій-калієвий насосом).
Обмін регулюється натрію гормонами щитовидної залози: при її недостатності натрій затримується в тканинах, а при гіперфункції натрій посилено виводиться з організму.
Біологічна роль натрію
підтримує осмотичний тиск і рН середовища
разом з калієм формує електричний потенціал мембран клітин, за рахунок якого передається сигнал в нервових клітинах, м'язових клітинах і пр.
бере участь у транспорті через мембрани клітин амінокислот, цукрів, неорганічних і органічних аніонів
бере участь в переносі оксиду вуглецю в крові
посилює виділення нирками різних продуктів метаболізму
бере участь у гідратації білків і розчиненні органічних кислот
бере участь в утворенні шлункового соку
активує ферменти слини і підшлункового соку
Слайд #20
Натрій міститься
Вміст натрію в продуктах досить невелика. Макроелемент входить до складу морської капусти, моркви, буряку, цикорію, кульбаби, селері. При приготуванні страв рекомендують застосовувати морську очищену сіль, тому як вона меншою мірою призводить до затримки води в організмі.
Вміст натрію в продуктах досить невелика. Макроелемент входить до складу морської капусти, моркви, буряку, цикорію, кульбаби, селері. При приготуванні страв рекомендують застосовувати морську очищену сіль, тому як вона меншою мірою призводить до затримки води в організмі.

Слайд #21
Біологічна роль калію
Калій разом з іншими найважливішими електролітами забезпечує необхідне осмотичний тиск у біологічних рідинах організму і в клітинах, є компонентом буферних систем, підтримує електричний потенціал на мембранах клітин всіх тканин.
Основні функції калію в організмі:
забезпечення збудливості і провідності клітин нервової системи та м'язових клітин, участь в передачі нервових імпульсів і скороченні м'язових клітин
підтримка осмотичного тиску в клітинах, тканинах і біологічних рідинах
забезпечення кислотно-лужної рівноваги
участь в нервовій регуляції серцевих скорочень
Калій сприяє постачанню мозку киснем, підвищуючи розумову активність, бере участь у передачі нервових імпульсів, знижує кров'яний тиск, очищає організм від токсинів і шлаків, допомагає при лікуванні алергічних захворювань.
Калій разом з іншими найважливішими електролітами забезпечує необхідне осмотичний тиск у біологічних рідинах організму і в клітинах, є компонентом буферних систем, підтримує електричний потенціал на мембранах клітин всіх тканин.
Основні функції калію в організмі:
забезпечення збудливості і провідності клітин нервової системи та м'язових клітин, участь в передачі нервових імпульсів і скороченні м'язових клітин
підтримка осмотичного тиску в клітинах, тканинах і біологічних рідинах
забезпечення кислотно-лужної рівноваги
участь в нервовій регуляції серцевих скорочень
Калій сприяє постачанню мозку киснем, підвищуючи розумову активність, бере участь у передачі нервових імпульсів, знижує кров'яний тиск, очищає організм від токсинів і шлаків, допомагає при лікуванні алергічних захворювань.
Слайд #22
Калій міститься
Калій міститься в моркві, картоплі, капусті, хроні, кропиві, цибулі, буряках, а також у бобових, яблуках, сухофруктах, винограді.
Калій міститься в моркві, картоплі, капусті, хроні, кропиві, цибулі, буряках, а також у бобових, яблуках, сухофруктах, винограді.

Слайд #23
Використання літію
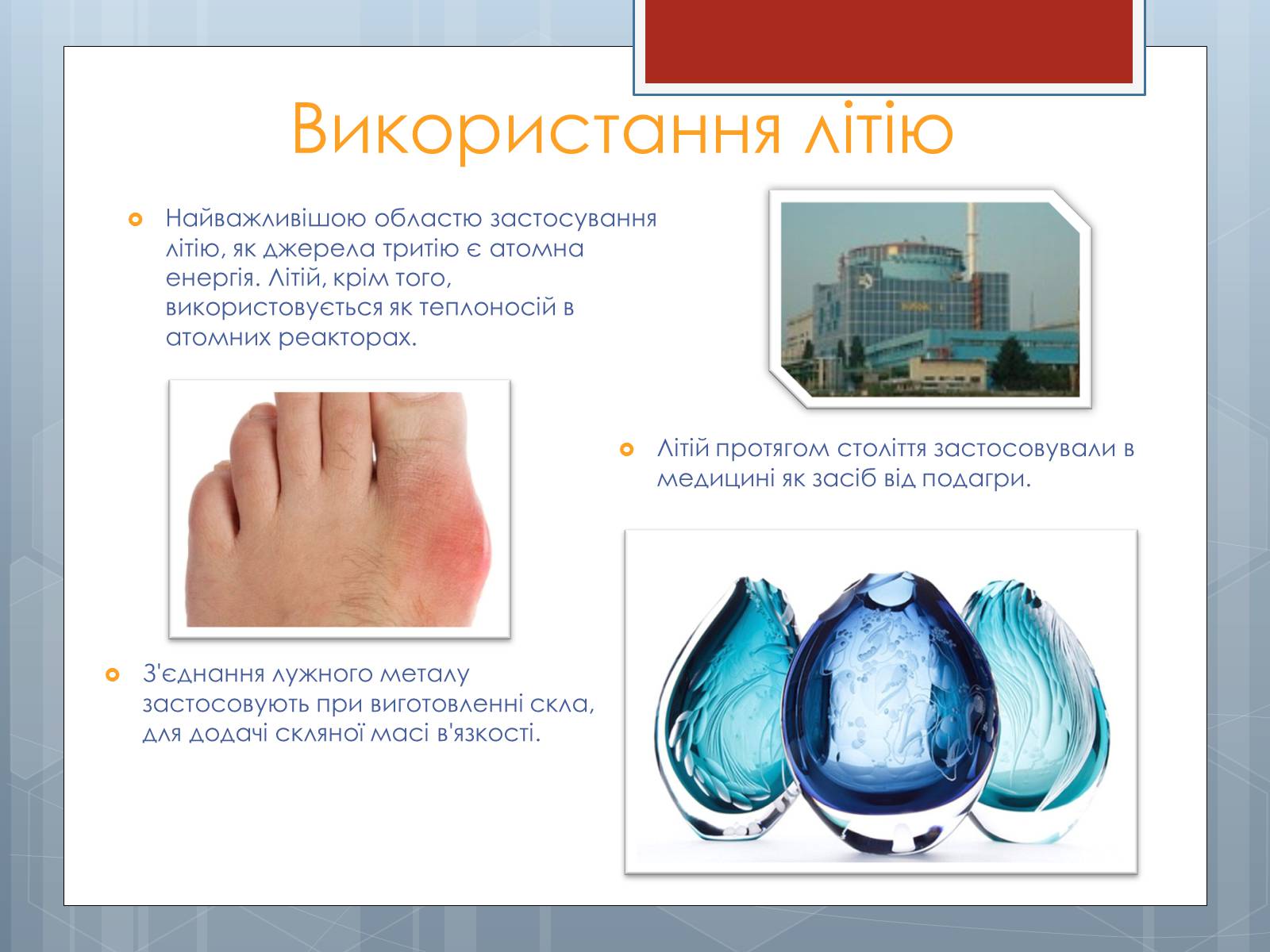
Найважливішою областю застосування літію, як джерела тритію є атомна енергія. Літій, крім того, використовується як теплоносій в атомних реакторах.
Літій протягом століття застосовували в медицині як засіб від подагри.
З'єднання лужного металу застосовують при виготовленні скла, для додачі скляної масі в'язкості.
Найважливішою областю застосування літію, як джерела тритію є атомна енергія. Літій, крім того, використовується як теплоносій в атомних реакторах.
Літій протягом століття застосовували в медицині як засіб від подагри.
З'єднання лужного металу застосовують при виготовленні скла, для додачі скляної масі в'язкості.
Слайд #24
Використання літію
Промислове використання літію почалося з першої світової війни, коли німецькі війська почали використовувати сплав літію і свинцю. Отримана німецька розробка виявилася відмінним матеріалом для покриття поверхонь, що труться. З цього моменту літій отримав своє законне місце в металургії. Його використовують у багатьох промислових сплавах.
Літій стали широко використовувати при видаленні газів, розчинених у розплавах металів. Зараз відомо, що літій здатний підвищити міцність сталі.
Промислове використання літію почалося з першої світової війни, коли німецькі війська почали використовувати сплав літію і свинцю. Отримана німецька розробка виявилася відмінним матеріалом для покриття поверхонь, що труться. З цього моменту літій отримав своє законне місце в металургії. Його використовують у багатьох промислових сплавах.
Літій стали широко використовувати при видаленні газів, розчинених у розплавах металів. Зараз відомо, що літій здатний підвищити міцність сталі.

Слайд #25
Використання натрію
Натрій використовується як теплоносій, а в сплаві з калієм - в атомній енергетиці в ядерних установках. Як відновник застосовується для отримання тугоплавких металів (титану, цирконію та ін),
пероксид натрію Na2O2 - для відбілення вовни, тканин, шовку та ін;
В якості каталізатора - в органічному синтезі і при отриманні синтетичного каучуку.
Натрій використовується як теплоносій, а в сплаві з калієм - в атомній енергетиці в ядерних установках. Як відновник застосовується для отримання тугоплавких металів (титану, цирконію та ін),
пероксид натрію Na2O2 - для відбілення вовни, тканин, шовку та ін;
В якості каталізатора - в органічному синтезі і при отриманні синтетичного каучуку.

Слайд #26
Використання натрію
гідроксид натрію NаОН - один з найбільш важливих продуктів хімічної промисловості: використовується для очищення продуктів переробки нафти, для виробництва штучного волокна, в миловарній, паперовій, текстильній та інших галузях промисловості.
гідроксид натрію NаОН - один з найбільш важливих продуктів хімічної промисловості: використовується для очищення продуктів переробки нафти, для виробництва штучного волокна, в миловарній, паперовій, текстильній та інших галузях промисловості.

Слайд #27
Використання солей натрію
Натрій з усіма кислотами утворює солі, які використовуються в житті людини і у всіх галузях промисловості:
сода кальцинована (карбонат натрію Nа2СО3) і питна (бікарбонат натрію NаНСОз) - основні продукти хімічної промисловості;
бромід натрію NаВг - використовується в медицині та у фотографії;
Натрій з усіма кислотами утворює солі, які використовуються в житті людини і у всіх галузях промисловості:
сода кальцинована (карбонат натрію Nа2СО3) і питна (бікарбонат натрію NаНСОз) - основні продукти хімічної промисловості;
бромід натрію NаВг - використовується в медицині та у фотографії;

Слайд #28
Використання солей натрію
фторид натрію NаF - в сільському господарстві, для обробки деревини, у виробництві емалей та ін.
хлорид натрію NаСl (кухонна сіль) - в техніці, медицині, в харчовій промисловості, для виробництва соди, їдкого натру та ін
фторид натрію NаF - в сільському господарстві, для обробки деревини, у виробництві емалей та ін.
хлорид натрію NаСl (кухонна сіль) - в техніці, медицині, в харчовій промисловості, для виробництва соди, їдкого натру та ін

Слайд #29
Використання солей натрію
дихромат натрію Na2Cr2O7 - як дубильну речовина і сильний окислювач (хромову суміш - розчин дихромату натрію і концентрованої сірчаної кислоти - використовують для миття лабораторного посуду);
нітрат натрію NaNO3 (натрієва селітра) - в якості азотного добрива;
дихромат натрію Na2Cr2O7 - як дубильну речовина і сильний окислювач (хромову суміш - розчин дихромату натрію і концентрованої сірчаної кислоти - використовують для миття лабораторного посуду);
нітрат натрію NaNO3 (натрієва селітра) - в якості азотного добрива;

Слайд #30
Використання солей натрію
силікат натрію NaSiO3 - розчинне скло
сульфат натрію Na2SO4 - в скляній, шкіряній, миловарній, текстильній, целюлозно-паперовій промисловості;
силікат натрію NaSiO3 - розчинне скло
сульфат натрію Na2SO4 - в скляній, шкіряній, миловарній, текстильній, целюлозно-паперовій промисловості;

Слайд #31
Використання калію
Рідкий при кімнатній температурі сплав калію і натрію використовується в якості теплоносія в замкнутих системах, наприклад, в атомних силових установках на швидких нейтронах. Крім того, широко застосовуються його рідкі сплави з рубідій і цезієм.
З'єднання калію - найважливіший біогенний елемент і тому застосовуються в якості добрив.
Солі калію широко використовуються в гальванотехніки, тому що, незважаючи на відносно високу вартість, вони часто більш розчинні, ніж відповідні солі натрію, і тому забезпечують інтенсивну роботу електролітів при підвищеній щільності струму.
Рідкий при кімнатній температурі сплав калію і натрію використовується в якості теплоносія в замкнутих системах, наприклад, в атомних силових установках на швидких нейтронах. Крім того, широко застосовуються його рідкі сплави з рубідій і цезієм.
З'єднання калію - найважливіший біогенний елемент і тому застосовуються в якості добрив.
Солі калію широко використовуються в гальванотехніки, тому що, незважаючи на відносно високу вартість, вони часто більш розчинні, ніж відповідні солі натрію, і тому забезпечують інтенсивну роботу електролітів при підвищеній щільності струму.

Слайд #32
Важливі з'єднання калію
Бромід калію застосовується в медицині і як заспокійливий засіб для нервової системи.
Гідроксид калію (їдке калі) застосовується в лужних акумуляторах і при сушінні газів.
Карбонат калію (поташ) використовується як добриво, при варінні скла.
Бромід калію застосовується в медицині і як заспокійливий засіб для нервової системи.
Гідроксид калію (їдке калі) застосовується в лужних акумуляторах і при сушінні газів.
Карбонат калію (поташ) використовується як добриво, при варінні скла.

Слайд #33
Важливі з'єднання калію
Хлорид калію (сильвін, «калійна сіль») використовується як добриво.
Нітрат калію (калійна селітра) - добриво, компонент чорного пороху.
Перхлорат і хлорат калію (бертолетова сіль) використовуються у виробництві сірників, ракетних порохів, освітлювальних зарядів, вибухових речовин, в гальванотехніки.
Хлорид калію (сильвін, «калійна сіль») використовується як добриво.
Нітрат калію (калійна селітра) - добриво, компонент чорного пороху.
Перхлорат і хлорат калію (бертолетова сіль) використовуються у виробництві сірників, ракетних порохів, освітлювальних зарядів, вибухових речовин, в гальванотехніки.

Слайд #34
Важливі з'єднання калію
Дихромат калію (хромпик) - сильний окислювач, використовується для приготування «хромової суміші» для миття хімічного посуду і при обробці шкіри (дублення). Також використовується для очищення ацетилену на ацетиленових заводах від аміаку, сірководню та фосфіну.
Перманганат калію - сильний окислювач, використовується як антисептичний засіб у медицині та для лабораторного одержання кисню.
Дигідрофосфат і дідейтерофосфат калію у вигляді монокристалів в лазерній техніці.
Дихромат калію (хромпик) - сильний окислювач, використовується для приготування «хромової суміші» для миття хімічного посуду і при обробці шкіри (дублення). Також використовується для очищення ацетилену на ацетиленових заводах від аміаку, сірководню та фосфіну.
Перманганат калію - сильний окислювач, використовується як антисептичний засіб у медицині та для лабораторного одержання кисню.
Дигідрофосфат і дідейтерофосфат калію у вигляді монокристалів в лазерній техніці.

Слайд #35
Важливі з'єднання калію
Хлорид калію (сильвін, «калійна сіль») використовується як добриво.
Фтороборат калію - важливий флюс для пайки сталей і кольорових металів.
Ціанід калію застосовується в гальванотехніки (сріблення, золочення), при видобутку золота та при нітроцементації сталі.
Хлорид калію (сильвін, «калійна сіль») використовується як добриво.
Фтороборат калію - важливий флюс для пайки сталей і кольорових металів.
Ціанід калію застосовується в гальванотехніки (сріблення, золочення), при видобутку золота та при нітроцементації сталі.
